Lire la suite

6
Introduction : les fonctions
cachées des racines
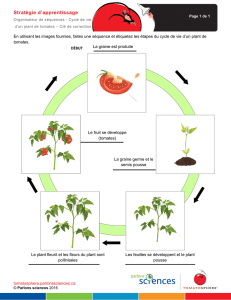
Le système racinaire, bien que constituant la partie
cachée des végétaux, est une composante essentielle
pour la vie de la plante (Barlow 2003). Les racines
assurent plusieurs fonctions vitales et permettent
principalement la nutrition en eau et en éléments
minéraux ainsi que l’ancrage du végétal dans le sol.
Par ailleurs, les racines sont le lieu de synthèse de phy-
tohormones transportées vers les parties aériennes
qui conditionnent la réponse de la plante entière aux
stress. Le système racinaire est une structure clé dans
les interactions plantes-micro-organismes interve-
nant dans la protection de la plante contre les stress
biotiques et abiotiques.
Ces diff érentes fonctions sont attribuées à des régions
précises de la racine. Les méristèmes sont respon-
sables de l’élaboration des nouveaux tissus racinaires,
tandis que l’accroissement en volume des cellules a
lieu dans la zone d’élongation. L’alimentation en eau et
en sels minéraux se fait dans des cellules diff érenciées
en poils absorbants dans la zone pilifère (Jones and
Dolan, 2012). La coiff e racinaire située à l’extrémité de
la racine est un organe vital permettant d’orienter la
croissance racinaire en fonction des conditions envi-
ronnementales (Barlow, 2003). Darwin (1880) avait
déjà souligné dans son livre l’importance de la coiff e
racinaire agissant comme le « cerveau » de la plante.
La coiff e est également à l’origine de la formation de
cellules particulières appelées « cellules bordantes »,
véritable interface physique, chimique et biologique
entre la racine et le sol (Hawes et al., 2000 ; Driouich
et al., 2010).
Interactions racines-micro-
organismes telluriques
Les racines sont en permanence en contact avec une
fl ore microbiologique diverse et variée incluant bac-
téries, champignons, oomycètes, virus et nématodes
(Bais et al., 2004). Certains de ces micro-organismes
du sol sont bénéfi ques pour la plante tels les cham-
pignons mycorhiziens ou les bactéries symbiotiques,
améliorant la nutrition de la plante, favorisant sa crois-
sance et sa défense. La racine est également confrontée
à de nombreux microbes entrant en compétition vis-
à-vis des ressources nutritives du sol ou susceptibles
d’engendrer des maladies dommageables à la plante. La
sécrétion d’exsudats racinaires dans le sol permet de
stimuler ou d’inhiber le développement de ces agents
microbiens telluriques et régule fortement la composi-
tion de la microfl ore de la rhizosphère (Walker et al.,
2003 ; Berendsen et al., 2012). Les exsudats racinaires
jouent donc un rôle considérable dans le maintien de
l’équilibre entre les diff érentes communautés du sol,
ce qui se répercute sur la santé de la plante entière et
par voie de conséquence sur le rendement des cultures.
La réponse immunitaire
des racines
Les systèmes de défense immunitaire des racines
contre les agressions des pathogènes ne sont pas com-
plètement identifi és et peu d’informations sont dis-
ponibles concernant la réponse aux éliciteurs tels que
les MAMPs (Microorganisms Associated Molecular
Patterns) au niveau racinaire (Attard et al., 2010 ;
Millet et al., 2010). L’hypothèse longtemps retenue
était que le système racinaire devait essentiellement
avoir recours à des stratégies de protection constitu-
tive (ex : paroi cellulaire plus imperméable). En eff et,
les racines étant constamment exposées aux micro-
organismes du sol, une trop grande stimulation du
système immunitaire serait trop coûteuse en énergie
pour la plante et se ferait aux dépens de la croissance
racinaire. Toutefois, il a récemment été démontré que
des éliciteurs bactériens (fl agelline 22 et peptidogly-
canne) induisent dans la racine d’Arabidopsis thaliana
une réponse immunitaire très localisée (Millet et al.,
2010). Les auteurs suggèrent que cette réponse aux
MAMPs se trouve ainsi restreinte aux zones les plus
vulnérables de la racine, afi n de limiter le coût éner-
La racine, organe d’interface entre la plante
et le sol
Maïté Vicré-Gibouin, Barbara Plancot, Marc Antoine Cannesan, Nguema-Ona
Éric, Marie-Laure Follet-Gueye, Azeddine Driouich

7
gétique pour la plante. Des études récentes soulignent
des réponses tissus-spécifi ques des racines aux patho-
gènes (Cannesan et al., 2011).
Des cellules « sentinelles »
à la frontière racines-sol
La majorité des plantes libèrent dans la rhizosphère
des milliers de cellules isolées appelées «cellules bor-
dantes». Lors de leur détachement de la coiff e raci-
naire, les cellules bordantes constituent un «tissu» à
part entière comprenant des cellules isolées les unes
des autres et incluses dans un épais mucilage (Hawes
et al., 2000). Les cellules bordantes de racine ont long-
temps été considérées comme des cellules mortes
se desquamant de la racine afi n de faciliter sa crois-
sance et protéger l’apex racinaire contre les forces
d’abrasion du sol. Il est maintenant reconnu que ces
cellules de racine jouent bien plus qu’un simple rôle
de protection mécanique et interviennent de façon
active dans la défense de la racine contre les stress
abiotiques (tolérance aux métaux lourds) et biotiques
(Hawes et al., 2000, 2003 ; Driouich et al., 2010). Du
fait de leur position à l’interface sol-racine, ces cel-
lules agissent comme de véritables cellules sentinelles
et sont impliquées dans de nombreuses interactions
racines-micro-organismes.
Non seulement les cellules bordantes sont vivantes,
mais leur détachement de la racine s’accompagne d’une
modifi cation importante dans l’expression des gènes
par comparaison avec les cellules de coiff e (Brigham et
al., 1995 ; Wen et al., 2007). Ces cellules de racine sont
particulièrement impliquées dans la protection contre
les pathogènes et sont spécialisées dans la synthèse
de molécules antimicrobiennes comme par exemple
des glucosidases chez le pois (Pisum sativum) ou de
la shikonine, une molécule aux propriétés antibio-
tiques, chez Lithospermum erythrorhizon. Par ailleurs,
des travaux décrivant des interactions entre cellules
bordantes et micro-organismes (bactéries, néma-
todes, champignons) révèlent des comportements
diff érents suivant le génotype de la plante et celui des
micro-organismes (Goldberg et al., 1989 ; Hawes et al.,
2000). Notamment les cellules bordantes infl uencent
les mécanismes de chimiotactisme et d’adhésion de
bactéries, de nématodes, de champignons ou d’oomy-
cètes. Par exemple, des cellules bordantes de pois sont
capables d’attirer des nématodes afi n de les immobi-
liser et de les empêcher d’accéder aux cellules de la
coiff e (Hawes et al., 2000).
Cellules bordantes de pois:
nouveau modèle d’étude
pour les interactions
racines-micro-organismes
Le pois constitue le modèle d’étude le plus utilisé pour
élucider le rôle des cellules bordantes vis-à-vis des
micro-organismes telluriques (Gunawardena et al.,
2005 ; Curlango-Rivera et al., 2010 ; Cannesan et al.,
2011). Plus d’une centaine de protéines sont sécrétées
dans le mucilage des cellules bordantes et la présence
d’ADN extracellulaire a également été mise en évi-
dence (Wen et al., 2007 ; 2009). Chez les mammifères,
il est maintenant établi que l’ADN extracellulaire
des cellules sanguines (neutrophiles, éosinophiles…)
contribue à la défense contre l’invasion par des élé-
ments pathogènes. Lors d’infection, l’ADN extracel-
lulaire forme un complexe avec les protéines et les
peptides permettant de piéger les micro-organismes
en les agglutinant pour pouvoir ensuite les éliminer
(Wartha et al., 2007 ; Medina et al ; 2009). Hawes et
al. (2011) suggèrent qu’un mécanisme similaire pour-
rait également exister chez les plantes. L’ADN extra-
cellulaire présent dans le mucilage conjointement
avec les protéines pourrait moduler l’agglutination et
l’adhésion des pathogènes contribuant à la protection
de la coiff e racinaire (Wen et al., 2009 ; Hawes et al.,
2011). De plus, les cellules bordantes de pois répondent
à l’infection par le pathogène Aphanomyces euteiches
en augmentant leur production de pisatine, la phyto-
alexine majeure chez cette espèce végétale (Cannesan
et al., 2011).
Des cellules atypiques
chez le lin et les brassicacées
Les cellules bordantes ont été décrites chez la majo-
rité des espèces végétales étudiées et leur production
est fi nement régulée (Hawes et al., 2000). Toutefois,
nous avons montré que chez les plantes appartenant
à la famille des brassicacées comme le colza (Brassica
napus) ou Arabidopsis thaliana, plante modèle de
laboratoire, des cellules bordantes atypiques sont
produites (Vicré et al., 2005 ; Driouich et al., 2007 ;
Durand et al., 2009). Ces cellules présentent la par-
ticularité d’adhérer les unes aux autres et à la coiff e
racinaire et ne sont jamais libérées individuellement.
Pour souligner cette diff érence d’organisation par
rapport aux cellules bordantes « classiques », nous
Cellules bordantes

8
les avons baptisées « cellules apparentées aux cellules
bordantes» ou « border-like cells ». Une telle organi-
sation a été décrite plus récemment également chez le
lin (Linum usitatissimum), une espèce économique-
ment importante pour des régions telles que la Haute-
Normandie ou la Picardie (Driouich et al., 2012).
Tandis que la fonction des cellules bordantes dans
la protection racinaire est démontrée chez le pois
(Hawes et al., 2000 ; Cannesan et al., 2011), le rôle
des cellules apparentées aux cellules bordantes reste
méconnu. Du fait de leur position particulière, les cel-
lules apparentées aux cellules bordantes sont particu-
lièrement exposées aux agents pathogènes. Il est donc
fort probable que ces cellules nécessitent également
une défense immunitaire effi cace pour se protéger et
pour protéger la coiff e racinaire sous-jacente.
Quelles perspectives pour
la protection des plantes de
grandes cultures et /ou horticoles ?
La compréhension des mécanismes de défense
impliqués au niveau de la racine en réponse aux
phytopathogènes telluriques est indispensable pour
développer à terme une protection plus respectueuse
de l’environnement des plantes de grandes cultures ou
des plantes horticoles contre les maladies. Les cellules
bordantes de racine, impliquées dans la synthèse de
molécules de défense, constituent un modèle d’étude
original et prometteur pour améliorer ces connais-
sances. Ces cellules sont des réservoirs potentiels de
molécules antimicrobiennes. Récemment, nous avons
montré que des polymères pariétaux appelées arabi-
nogalactanes-protéines, issus d’apex racinaire de pois,
interfèrent avec le cycle infectieux du pathogène A.
euteiches. Ainsi nous avons proposé l’utilisation de
ces arabinogalactanes-protéines comme nouvelles
molécules antimicrobiennes (Cannesan et al., 2012 ;
Nguema-Ona et al., 2012). Ces résultats prometteurs
sur l’eff et des arabinogalactanes-protéines contre les
pathogènes permettent d’envisager de nouvelles stra-
tégies de lutte biologique pouvant être appliquées aux
plantes horticoles ou aux plantes de grandes cultures.
Références
Attard A., Gourgues M., Callemeyn-Torre N., Keller H.
(2010), New Phytologist 187 : 449-460.
Bais H.P., Park S.W., Weir T.L., Callaway R.M., Vivanco
J.M. (2004), Trends in Plant Science 9 : 26-32.
Barlow P.W. (2003), Journal of Plant Growth Regulation 21:
261-286.
Berendsen R.L., Pieterse C.M., Bakker P.A. (2012), Trends
in plant science. 17 : 478-486.
Brigham L.A., Woo H.H., Nicoll S.M., Hawes M.C. (1995),
Plant Physiology 109 : 457-463.
Cannesan M.A., Gangneux C., Lanoue A., Giron D., Laval
K., Hawes M., Driouich A., Vicré-Gibouin M. (2011), Ann
Bot 108 : 459-469
Cannesan M.A., Durand C., Burel C., Follet-Gueye M.L.,
Lerouge P., Ishii T., Driouich A., Vicré-Gibouin M. (2012),
Plant Physiology 159 : 1658-1670
Curlango-Rivera G., Duclos D.V., Ebolo J.J., Hawes M.
(2010), Plant and Soil 332: 267-275.
Driouich A., Durand C., Vicré-Gibouin M. (2007), Trends
in Plant Science 12 : 14-19.
Driouich A., Durand C., Cannesan M.A., Percoco G.,
Vicré-Gibouin M. (2010), Journal of Experimental Botany
14 : 3827-3831.
Driouich A., Cannesan M.A., Dardelle F., Durand C.,
Plancot B., Bernard S., Follet-Gueye M.L. and Vicré-
Gibouin M. (2012), In, Signaling and communication in
Plants. Edited by F. Baluska/ J. Vivanco
Durand C., Vicré-Gibouin M., Follet-Gueye M.L.,
Duponchel L., Moreau M., Lerouge P., Driouich A. (2009),
Plant Physiology 150 : 1411-1421.
Goldberg N.P., Hawes M.C., Stanghellini M.E. (1989),
Canadian Journal of Botany 67 : 1760-1767.
Gunawardena U., Rodriguez M., Straney D., Romeo J.T.,
VanEtten H.D., Hawes M.C. (2005), Plant Physiology 137:
1363-1374.
Hawes M.C., Gunawardena U., Miyasaka S., Zhao X. (2000),
Trends in Plant Science 5 : 128-133.
Hawes M.C., Bengough G., Cassab G., Ponce G. (2003),
Journal of Plant Growth Regulation 21 : 352-367.
Hawes M.C., Curlango-Rivera G., Wen F., White G.J.,
VanEtten H.D., Xiong Z. (2011) Plant Science 180 : 741-745.
Jones V.A., Dolan L. (2012), Ann Bot 110 : 205-212.
Medina E. (2009), Journal of Innate Immunity 1 : 176–179.
Millet Y.A., Danna C.H., Clay N.K., Songnuan W., Simon
M.D., Werck-Reichhart D., Ausubel F.M. (2010), e Plant
Cell 22: 973-990.
Nguema-Ona E., Coimbra S., Vicré-Gibouin M., Mollet
J.C., Driouich A. (2012), Ann Bot. 110 : 383-404.
Vicré M., Santaella C., Blanchet S., Gateau A., Driouich A.
(2005), Plant Physiology 138 : 998-1008.
Walker T.S., Bais H.P., Grotewold E., Vivanco J.M. (2003),
Plant Physiol 132 : 44-51.
Wartha F., Beiter K., Albiger B., Fernebro J., Zychlinsky
A., Normark S., Henriques-Normark B. (2007), Cell
Microbiology 9 : 1162–1171.
Wen F., VanEtten H.D., Tsaiprailis G., Hawes M.C. (2007),
Plant Physiology 143 : 773-783.
Wen F., White G.J., Van Etten H.D., Xiong Z., Hawes M.C.
(2009), Plant Physiology 151 : 820-829.
1
/
3
100%