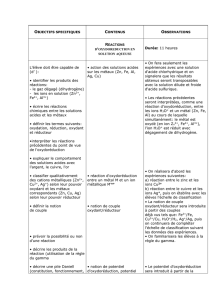
LES RÉACTIONS D`OXYDORÉDUCTION

T BEP janvier 2005
PhG-Chimie page 1/3
LES RÉACTIONS D'OXYDORÉDUCTION
Une réaction d'oxydoréduction est une réaction chimique au cours de laquelle il y a
simultanément une oxydation et une réduction.
Il n'y a pas si longtemps, une oxydation était définie comme une "fixation" d'oxygène sur un
atome ou une molécule et une réduction était le "départ" de ce même atome. Ce modèle ne
permettait pas d'expliquer beaucoup de situation.
La théorie, depuis, a été affinée et on associe désormais, à toute oxydation et à toute réduction,
un transfert d'électrons.
L'élaboration de presque tous les métaux passe par des réactions d'oxydoréduction. Il en est de
même pour la synthèse des produits de base comme HCl et sa solution aqueuse l'acide
chlorhydrique, l'acide sulfurique, l'hydroxyde de sodium.
La corrosion des métaux et l'électrolyse sont basés sur l'oxydoréduction. Les piles et les
accumulateurs fonctionnent grâce à de telles réactions.
Tout simplement, des choses aussi naturelles que la respiration ou la digestion des aliments sont
des processus d'oxydoréduction.
I- Oxydation et réduction
Une oxydation est une perte d'électrons Cu Cu 2 + + 2 e –
Une réduction est un gain d'électrons Cu 2 + + 2 e – Cu
Un métal oxydé subit une oxydation alors qu'un métal réduit subit une réduction.
Remarques :
une réduction est un gain d'une charge négative (électron(s)).
le fait de perdre/gagner des électrons se traduit par un accroissement/diminution de charge.
un métal oxydé voit sa charge augmenter (formation d'un ion positif) en perdant des électrons.
II- Oxydant et réducteur
Les deux réactions d'oxydoréduction possibles pour le cuivre Cu Cu 2 + + 2 e –
caractérisent le couple Cu2+ / Cu. Cu 2 + + 2 e – Cu
L'ion Cu2+ est l'oxydant du couple Cu2+ / Cu. Le métal Cu est le réducteur du couple Cu2+ / Cu.
D'une façon générale, un couple oxydant-réducteur est noté Ox / Red.
Dans l'écriture des couples, l'oxydant est toujours à gauche et le réducteur à droite Ox / Red.
Pour les métaux, le cation est l'oxydant et l'atome le réducteur.
Exemple du couple Fe 3 +/ Fe : le cation Fe 3 +est l'oxydant Ox, l'atome Fe est le réducteur Red.

PhG-Sciences page 2/3
III- Classification des couples métalliques
Les couples Ox / Red sont classés dans le tableau des potentiels normaux
d'oxydoréduction.
Les cations métalliques Ox sont classés suivant leur pouvoir oxydant
croissant vers le haut.
Les atomes Red sont classés suivant leur pouvoir réducteur croissant vers
le bas.
Remarque : Le couple au sommet de la classification possède l'oxydant le
plus fort et le réducteur le plus faible.
Cu2+
0,34
Cu
Pb2+
– 0,13
Pb
Fe2+
– 0,44
Fe
Zn2+
– 0,76
Zn
Al3+
– 1,66
Al
IV- Réaction d'oxydoréduction
Une réaction d'oxydoréduction nécessite la présence de 2 couples oxydant-réducteur :
Ox 1 / Red 1 et Ox 2 / Red 2
L'oxydant d'un couple réagit avec le réducteur de l'autre couple.
La réaction possible a lieu entre l'oxydant le plus fort des deux couples et le réducteur le plus
fort des deux couples. Ox 1 + Red 2 Ox 2 + Red 1
les plus forts
Ils donnent le réducteur le plus faible et l'oxydant le plus faible.
Un oxydant peut oxyder tout réducteur situé en dessous de lui.
Remarque : Pour prévoir si une réaction d'oxydoréduction est possible entre un oxydant et un
réducteur, il suffit de vérifier que l'oxydant est plus fort que celui du réducteur.
La réaction d'oxydoréduction : Ox 1 + Red 2 Ox 2 + Red 1
Ox 1 subit une réduction.
Red 2 subit une oxydation.
La réduction a lieu de Ox 1 vers Red 1.
L'oxydation a lieu de Red 2 vers Ox 2.
Un couple réagit dans le sens de l'oxydation et l'autre dans celui de la réduction.
Exemple de réaction d'oxydoréduction : Cu 2 + + Zn Cu + Zn 2 +
Le couple oxydant-réducteur Cu 2 + / Cu évolue dans le sens d'une réduction. L'ion Cu 2 + est réduit.
Le couple oxydant-réducteur Zn 2 + / Zn évolue dans le sens d'une oxydation. Le métal Zn est oxydé.
réduction
oxydation
Pouvoir oxydant
croissant
Pouvoir réducteur
croissant

T BEP janvier 2005
PhG-Chimie page 3/3
Application : Écrire l'équation-bilan de la réaction possible entre les couples ion/métal suivants :
Ag+ / Ag et Al3+ / Al
Sn2+ / Sn et Al3+ / Al
Règle du gamma : Tracer un gamma minuscule entre les deux couples situés dans la classification électrochimique
(pouvoir oxydant croissant vers le haut). La règle du gamma permet de prévoir la réaction possible entre deux couples.
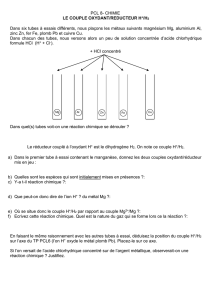
V- Action des solutions acides sur les métaux
Les solutions diluées d'acide contiennent l'ion H3O+ (ou H+) responsable de l'attaque des métaux par les
acides. L'ion H3O + est alors réduit en dihydrogène H2.
L'ion H+ (ou H3O+) de la solution acide, est l'oxydant associé au réducteur H2.
Pour une solution acide, on considère le couple oxydant-réducteur H3O+ / H2.
La position du couple H3O+ / H2 dans la classification électrochimique permet de prévoir les métaux attaqués
par l'acide.
Les solutions d'acide réagissent avec les métaux plus réducteurs que le dihydrogène comme
le plomb Pb, le fer Fe, le zinc Zn et l'aluminium Al.
Les solutions d'acide ne réagissent pas avec les métaux moins réducteurs comme le cuivre,
l'or et l'argent.
Lors des réactions le gaz produit est du dihydrogène H2 (il brûle avec un petit jappement).
Le pH augmente au cours de la réaction (les ions H+ sont consommés).
Exemple : Action d'un acide sur le métal zinc : 2 H+ + Zn Zn2+ + H2
Le métal zinc, réducteur, a été oxydé en ion Zn2+.
L'ion H+, oxydant, a été réduit en dihydrogène H2.

PhG-Sciences page 4/3
EXEMPLES DE RÉACTIONS D'OXYDORÉDUCTION
PAR VOIE SÈCHE
Transfert électronique évident
Combustion du magnésium dans le dioxygène
Production d'une lumière intense mis à profit dans les premiers flashes
La réaction très exothermique donne naissance à un solide blanc, l'oxyde de magnésium.
Mg +
Error!
O2
Error!
MgO
L'étude de MgO aux rayons X a montré que c'est un oxyde ionique à structure cubique comme le
chlorure de sodium.NaCl.
Transfert d'électrons entre le magnésium et le dioxygène : c'est une réaction
d'oxydoréduction entre un solide et un gaz
Combustion du sodium dans le dichlore
Placé dans un têt, le sodium brûle dans l'air avec une flamme jaune. Dans le flacon de dichlore, la
combustion se poursuit avec formation d'abondantes fumées blanches de chlorure de sodium naCl
solide. Na +
Error!
Cl2
Error!
NaCl
Transfert d'électrons entre le sodium (liquide) et le dioxygène (gazeux).
Réaction entre l'aluminium et l'oxyde Fe2O3 (aluminothermie)
Placer dans un creuset en terre réfractaire un mélange intime de poudres d'aluminium (11 g) et
d'oxyde de fer III Fe2O3 (32 g).
Porter le mélange à incandescence par l'intermédiaire d'un petit ruban de magnésium que l'on
enflamme à l'aide d'un bec bunsen.
La réaction est très vive (flamme de 0,5 à 1 m de hauteur et projections diverses) et l'on recueille une
masse incandescente liquide (elle coule à travers le trou au fond du creuset) qui, après
refroidissement est attiré par un aimant : c'est du fer. Il s'est également produit un solide blanc
pulvérulent, de l'oxyde d'aluminium Al2O3 (alumine).
Fe2O3 + 2 Al
Error!
Al2O3 + 2 Fe
L'aluminothermie de l'oxyde Fe2O3 est une réaction d'oxydoréduction au cours de laquelle il
y a transfert d'électrons entre un métal, l'aluminium, et les ions Fe3+ de l'oxyde Fe2O3.
Fe2O3 + Al
en poudre
feuille de
papier
creuset en
terre
réfractaire
creuset en
terre
ruban de
magnésium

T BEP janvier 2005
PhG-Chimie page 5/3
VERSION PRECEDENTE
II- Oxydant et réducteur
Les deux réactions d'oxydoréduction possibles pour le cuivre sont résumées dans l'écriture globale
Cu2+ + 2 e – Cu qui caractérise le couple Cu2+ / Cu.
L'ion Cu2+ est l'oxydant du couple Cu2+ / Cu.
Le métal Cu est le réducteur du couple Cu2+ / Cu.
D'une façon générale, entre un métal M et le cation Mn+ qui lui correspond, il est possible de passer
chimiquement :
de M à M n + par oxydation du métal
de M n + à M par réduction du cation
Cela se traduit par la demi-équation réversible : M n + + n e – M
associée au couple oxydant-réducteur : M n + / M
Dans l'écriture des couples, l'oxydant est toujours à gauche et le réducteur à droite Ox / Red.
Attention : l'écriture de la demi-équation ne signifie pas que les deux réactions inverses se
produisent simultanément. Dans certaines conditions les ions sont réduits et
dans d'autres les atomes sont oxydés.
III- Réaction d'oxydoréduction
Une réaction d'oxydoréduction nécessite la confrontation de l'oxydant d'un couple avec le
réducteur d'un autre couple.
L'oxydant le plus fort des deux couples réagit avec le réducteur le plus fort des deux couples.
Ils donnent le réducteur et l'oxydant les plus faibles.
On considère deux couples oxydant-réducteur : Ox 1 / Red 1 et Ox 2 / Red 2.
La réaction d'oxydoréduction : Ox 1 + Red 2 Ox 2 + Red 1
Ox 1 subit une réduction.
Red 2 subit une oxydation.
La réduction a lieu de Ox 1 vers Red 1.
L'oxydation a lieu de Red 2 vers Ox 2.
Un couple réagit dans le sens de l'oxydation et l'autre dans celui de la réduction.
Application : Écrire l'autre réaction d'oxydoréduction possible.
réduction
oxydation
 6
6
 7
7
1
/
7
100%