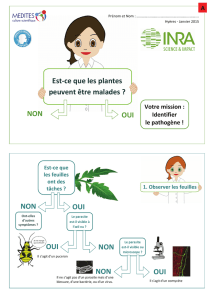
Communiqué de presse

DEPARTEMENT DES RELATIONS EXTERIEURES
Communication Recherche
Aéropole de Charleroi
Av. Lemaître 19 – 6041 Charleroi
Nathalie Gobbe, T +32 (0)71 60 02 06, +32 (0)474 84 23 02,
M [email protected]c.be
Nancy Dath, T +32 (0)71 60 02 03, M ndath@ulb.ac.be
Communiqué de presse
Charleroi, le 5 mai 2008
Maladie du sommeil, publication dans Science : des chercheurs de l’ULB (IBMM)
découvrent une nouvelle voie d’accès au parasite responsable de la maladie
Le laboratoire de parasitologie moléculaire – Institut de biologie et de médecine
moléculaires – de l’ULB présente dans la revue Science du 2 mai 2008, la découverte
inattendue d’une « porte d’entrée » du trypanosome Africain, parasite responsable de la
maladie du sommeil. Il s’agit d’un récepteur de la surface du parasite, qui organise la
capture et l’intériorisation de l’hémoglobine de l’hôte. Lors de l’infection chez l’homme, ce
récepteur est aussi impliqué dans la capture du facteur sérique qui conduit à la mort du
parasite. Ces découvertes ouvrent de nouvelles perspectives thérapeutiques concernant
la maladie du sommeil humaine et le nagana qui décime les troupeaux et rend impossible
l’élevage du bétail en Afrique centrale.
Dans l’édition du 2 mai 2008 de la revue Science, le laboratoire de parasitologie
moléculaire de l’ULB rapporte la découverte d’un récepteur de surface totalement
inattendu chez le parasite Trypanosoma brucei, responsable de maladies dévastatrices
sur le continent africain (maladie du sommeil humaine, nagana du bétail). Ce récepteur
fixe spécifiquement le complexe formé par l’hémoglobine avec l’haptoglobine. Lorsque
l’hémoglobine est libérée des globules rouges (notamment dans des situations
pathologiques), elle est immédiatement associée à l’haptoglobine, pour récupération du
complexe par un récepteur présent à la surface des macrophages (récepteur appelé
CD163).
Les recherches montrent que le trypanosome a également conçu un récepteur de ce
type. Le but poursuivi par le parasite semble être de capter un composant essentiel de
l’hémoglobine, appelé « hème », qui porte une molécule de Fer. Une fois intériorisé dans
le trypanosome, l’hème est incorporé dans des protéines dont l’activité permet au
parasite de résister à l’attaque oxydante des macrophages, qui sont des cellules

spécialisées dans la défense contre les pathogènes. Par conséquent, le récepteur identifié
ici permet au trypanosome de résister aux défenses de son hôte.
La découverte de ce récepteur permet aussi d’expliquer un paradoxe lié à l’immunité
naturelle de l’homme contre le trypanosome africain. On sait en effet depuis longtemps
(Laveran, 1902) que le sang humain se distingue par la présence d’un antidote très
efficace contre ce parasite, et que la maladie du sommeil est due à l’apparition de
trypanosomes « mutants » capables de résister à cet antidote. Les travaux du
Laboratoire de parasitologie moléculaire ont permis de démontrer que le composant
sanguin actif contre les trypanosomes, appelé apoL1, est contenu dans des particules
d’HDL porteuses aussi d’une protéine très semblable à l’haptoglobine (« haptoglobin-
related protein », ou Hpr) (voir résumé de ces recherches en annexe). Or, le récepteur
identifié ici fixe aussi bien l’Hpr que l’haptoglobine, lorsque l’une ou l’autre de ces
protéines est complexée à l’hémoglobine. Donc, chez l’homme, ce récepteur organise
l’intériorisation dans le parasite, des particules d’HDL porteuses du complexe Hpr-
hémoglobine. Ces particules portent aussi l’apoL1, toxine qui tue le trypanosome, ce qui
explique comment et pourquoi les trypanosomes mangent avidement des particules qui
les tuent. En conséquence certaines HDLs humaines peuvent être assimilées à des
« chevaux de Troie » capables d’éliminer certains pathogènes.
Ces recherches ouvrent de toutes nouvelles voies de lutte contre le parasite: en effet le
récepteur du trypanosome diffère de son analogue humain par le fait qu’il reconnaît le
complexe Hpr-hémoglobine, en plus du complexe haptoglobine-hémoglobine. On peut
donc imaginer cibler des toxines sur le parasite en les couplant à l’Hpr. Seul le parasite
devrait être affecté et pas l’hôte. Une demande de brevet a d’ores et déjà été introduite.
Informations scientifiques :
Etienne Pays, laboratoire de parasitologie moléculaire, IBMM-ULB : 02 650 97 59 ou
« A Haptoglobin-Hemoglobin Receptor Conveys Innate Immunity to Trypanosoma brucei
in Humans », Benoît Vanhollebeke, Géraldine De Muylder, Marianne J. Nielsen, Annette
Pays, Patricia Tebabi, Marc Dieu, Martine Raes, Soren K. Moestrup, Etienne Pays,
Science, 02 May 2008

Annexe. Rétroactes des recherches dirigées par le Professeur Etienne Pays, IBMM-ULB
On sait depuis longtemps que le sang humain se caractérise par la présence d’un
antidote très efficace contre le trypanosome africain (Trypanosoma brucei). Or, certains
« mutants » de T. brucei, appelés « gambiense » et « rhodesiense » sont apparus : ces
parasites résistent à notre défense innée et sont donc redevenus capables d’infecter
l’homme en provoquant la maladie du sommeil.
En 1998 (Cell), le laboratoire de parasitologie moléculaire de l’ULB a identifié la protéine
SRA (Serum-Resistance Associated), grâce à laquelle un des « mutants » pathogènes
pour l’homme, T. brucei rhodesiense, résiste à notre défense innée.
En 2003 (Nature), le même laboratoire a montré comment SRA bloque notre défense
innée, en neutralisant une protéine du sang humain appelée apolipoprotéine L1 (apoL1),
qui est propre à l’homme et est associée aux HDLs. Cette dernière protéine a été
identifiée comme étant le facteur responsable de notre défense contre le trypanosome.
En 2005 (Science), le laboratoire de l’IBMM a décortiqué le mécanisme par lequel l’apoL1
tue les trypanosomes : cette protéine induit un flux d’ions chlorure dans la vacuole
digestive du parasite. Ce flux ionique entraîne un gonflement incontrôlable de la vacuole
par entrée d’eau, ce qui à terme « asphyxie » le parasite.
En 2007 (Proceedings of the National Academy of Sciences USA), les chercheurs ont
proposé que l’apoL1 est ingurgitée par le trypanosome parce que ce dernier reconnait
une protéine particulière sur les particules d’HDL auxquelles l’apoL1 est associée : il
s’agit d’une autre protéine spécifiquement humaine appelée « haptoglobin-related
protein » ou Hpr. C’est donc le récepteur impliqué dans la reconnaissance de l’Hpr qui est
maintenant identifié.
1
/
3
100%