Transformation en chimie organique Chimie TS Analyses de

Transformation en chimie organique Chimie TS
Analyses de réactions en chimie organique
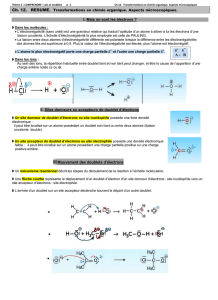
Une réaction chimique se décrit au niveau microscopique par des mouvements d’électrons. Il s’agit
ici de modéliser ces phénomènes.
1. Etude de documents
1.1. Calculer la différence d’électronégativité entre les deux atomes mis en jeu dans les liaisons
H-H et C-H. Ces liaisons sont-elles polarisées ?
1.2. Calculer la différence d’électronégativité entre les deux atomes mis en jeu dans les liaisons
suivantes, puis prévoir leur polarisation, en faisant apparaître les charges partielles - et + :
N-H O-H C-O
1.3 Pour chaque représentation de la figure 2, justifier la charge portée par les atomes Cl, N et C en
faisant le décompte des doublets liants ou non liants entourant ces atomes.
1.4. Donner la représentation de Lewis des espèces chargées :
H+ ; H- ; HO- ; H3C-CH2+ ; H3C-CO2-; Br- ; H3CO- ; NH2-.
1.5. Calculer la différence d’électronégativité entre les deux atomes mis en jeu dans la liaison C=O,
puis prévoir sa polarisation. En déduire ce qui, au sein de cette liaison, permet d’expliquer le sens
du déplacement du doublet d’électrons modélisé par la flèche 1 de la figure 4.
1.6. Réécrire l’étape de la figure 4 en ne représentant que le déplacement du doublet d’électrons
modélisé par la flèche 1. Dans l’espèce formé dans ce cas, quelle est la charge portée par l’atome de
carbone central ? Respecte-t-il la règle de l’octet ? En déduire pourquoi l’arrivée de la flèche 1 sur
l’atome de carbone déclenche le départ de la flèche 2.
2. Synthèse de l’éthanoate d’éthyle
La réaction chimique entre l’acide éthanoïque et l’éthanol est une estérification qui forme de
l’éthanoate d’éthyle et de l’eau. L’éthanoate d’éthyle est principalement utilisé comme solvant.
2.1. Ecrire la réaction entre l’équation de cette estérification en utilisant la représentation de Lewis
pour les réactifs et les produits.
2.2. La réaction d’estérification met en jeu un catalyseur, l’acide sulfurique, qui fournit des ions
hydrogène H+. Cet ion est-il un site donneur ou accepteur de doublet d’électrons ?
La première étape du mécanisme réactionnel est une étape de protonation de l’acide éthanoïque, qui
peut s’écrire :
2.3. Identifier, dans la molécule d’acide éthanoïque, le site donneur de doublet d’électrons
permettant d’expliquer la formation de la liaison entre O et H. Relier par une flèche courbe les sites
donneurs et accepteur d’électrons identifiés.

Transformation en chimie organique Chimie TS
Les deuxième et quatrième étapes du mécanisme réactionnel de la réaction d’estérification sont les
suivantes :
2.4. A chaque étape, associer un des termes de la liste suivante :
protonation ; déprotonation ; addition d’éthanol ; élimination d’eau.
2.5. Relier par une flèche courbe les sites donneur et accepteur de doublets d’électrons et
représenter, si nécessaire, toute autre flèche courbe qui explique la formation ou la rupture des
liaisons mises en jeu.
2.6. A partir de l’exemple de ce mécanisme réactionnel, un site donneur de doublets d’électrons
peut-il être uniquement localisé sur un atome possédant un doublet non liant ? Sur quel type
d’atome peut être localisé un site accepteur de doublet d’électrons ?
3. Une investigation à mener…
Poursuivi par Sherlock Holmes, le professeur Moriarty a laissé échapper le document
ci-dessous de sa poche :
A
Cl
B
Cl Cl
OH
C
Cl2,
Cl
D
OOH OH
OH
E : glycérine
HOCl base NaOH/H2O
Il faut aider Sherlock Holmes à trouver le but poursuivi par Moriarty !
3.1. Donner les formules semi-développées planes et les formules brutes des composés A à E.
3.2. À quelle famille de composé appartiennent les composés A et B ?
3.3. Entourer les groupes caractéristiques et les nommer dans les molécules B et E.
3.4. Sherlock Holmes a entendu Moriarty utiliser les termes addition, substitution et élimination.
Comprenant que ces mots ne s’appliquent pas à des personnes mais à des réactions chimiques,
expliquer par une phrase comment on passe de A à B, de B à C, de C à D et de D à E en employant
le terme qui semble approprié.
3.5. Pourquoi Moriarty veut-il fabriquer de la glycérine ? (Une recherche sur Internet vous
permettra d’avoir des connaissances aussi étendues que celles de Sherlock en chimie…)

Transformation en chimie organique Chimie TS

Transformation en chimie organique Chimie TS
1.1. H-H = 0 ; la liaison H-H n’est pas polarisée. C-H = 0,35 : la liaison C-H est très faiblement
polarisée.
1.2. N-H : 0,84 O-H : 1,24 C-O:0,89
1.3. Dans la représentation de Lewis de l’ion chlorure, l’atome de chlore a perdu un doublet liant et
a gagné un doublet non liant : il porte donc une charge -, car à la différence de la liaison covalente,
les deux électrons du doublet non liant lui sont comptés.
Dans la représentation de Lewis de l’ion ammonium, l’atome d’azote a perdu un doublet non liant
et a gagné un doublet liant. Il porte donc une charge + ; c’est la même chose pour l’atome de
carbone.
1.4.
1.5. La différence d’électronégativité est de 0,89. La liaison est polarisée, le carbone porte la charge
partielle positive et l’oxygène la négative. Le carbone est donc un site déficient en électrons vers
lequel se déplace le doublet non liant de H+.
1.6.
L’atome de carbone central porte une charge négative. Il ne respecte pas la règle de l’octet car il est
entouré de 5 liaisons covalentes au lieu de 4. Le départ de la flèche 2 permet que le carbone ne porte
pas de charge négative et qu’il respecte donc la règle de l’octet.
2.1.
2.2. L’ion H+ porte une charge positive. C’est un site accepteur d’électrons.
2.3. Le site donneur d’électrons est l’atome d’oxygène de la liaison C=O.
2.4. Etape 2 : addition d’éthanol ; Etape 4 : protonation.

Transformation en chimie organique Chimie TS
pour l’étape 2
pour l’étape 4.
2.6. Non, un site donneur de doublets peut être localisé entre deux atomes. Un site accepteur peut
être localisé sur un atome possédant une charge entière positive ou sur l’atome d’une liaison
polarisée.
3.1. C3H6 C3H5Cl C3H5Cl2OH C3H5OCl C3H6(OH)3
3.2. A: alcène; B: dérivé halogéné (chloré).
3.3 Cl ; OH
3.4. A à B : substitution d’un Cl à un H ;
B à C : addition de Cl et OH sur C=C ;
C à D : Elimination de HCl ;
D à E : substitution de OH à Cl et O.
3.5. Avec la glycérine de synthèse, on peut fabriquer de la nitroglycérine ! Moriarty prépare
sûrement un coup fumant…
 6
6
1
/
6
100%