Introduction - Nathalie Rion

Montage n° 22
Expériences illustrant les propriétés d'un même élément à différents degrés
d'oxydation.
Introduction
Le fer est un élément chimique, de symbole Fe et de numéro atomique 26. C’est un métal qui est
également un élément de transition.
Le métal fer ne se trouve pratiquement pas sur terre à l’état natif ; il fut l’un des premiers métaux
élaborés par l’homme (vers -1100 av JC : début de l’Age du fer) à partir d’une terre riche ne
hématite (Fe2O3), magnétite (Fe3O4) ou limonite (HFeO2), en présence de charbon. Ce fut
l’élément essentiel de la révolution industrielle.
Le fer est un métal qui, en fonction de la température, se présente sous plusieurs formes
allotropiques :
fer α ou ferrite : CC
fer γ ou austénite : CFC
fer δ : CC
Le fer est ferromagnétique : les moments magnétiques des atomes s'alignent sous l'influence d'un
champ magnétique extérieur et conservent leur nouvelle orientation après la disparition de ce
champ. Des courants de convection riches en fer liquide dans la couche externe du noyau
terrestre (noyau externe) sont supposés être à l'origine du champ magnétique terrestre.
Nous allons, dans ce montage, étudier les différentes propriétés du fer à différents degrés
d’oxydation.
I. Le fer métal (degré d’oxydation 0)
Le fer et ses alliages (dont les principaux sont l’acier et la fonte) sont très utilisés aujourd’hui.
Cependant, ils subissent des altérations irréversibles qui ont un impact économique considérable :
la corrosion (rouille Fe2O3). En effet, ¼ du fer produit chaque année ne sert qu’au remplacement
des objets.
I.1 Le phénomène de corrosion
[1] L’oxydation du fer se produit généralement sous l’influence de 2 facteurs simultanés :
l’humidité et la présence de dioxygène. La présence d’un électrolyte forte (type NaCl) favorise
cette corrosion.
Pour éviter la formation de la rouille, différentes techniques sont utilisées. La plus simple est
d’isoler le fer afin qu’il ne soit pas en contact avec l’air. Une couche protectrice peut être déposée,
par exemple au moyen d’une peinture ou d’une feuille de plastique. Des méthodes
électrochimiques sont également possibles. Nous allons les développer maintenant.
I.1.1 Protection par anode sacrificielle
Sarrazin p.287 - 100 Manip n°61.3 p.173 – Le Maréchal p.218
Réaliser l’expérience. Fe + H+ Fe2+ + H2
Constater que dégagement sur Zn supérieur au dégagement sur le fer. Relier ensemble Zn
et fer : on constate que c’est Zn qui est corrodé. Dégagement de H2 sur le fer.
Procédé couramment utilisé pour protéger les pièces en acier présentes à bord des
bateaux. Pour les petits bateaux, un cône en zinc est fixé à l’hélice et remplacé
annuellement.
I.1.2 Passivation du fer
Sarrazin p.236 - 100 Manip n°61.3 p.173 – Le Maréchal p.220
I.1.2.1 Action de l'acide nitrique dilué sur le fer :
Dans un petit bécher introduire de l'acide nitrique 5 M. Fe + 3HNO3 + 3H+ Fe3+ + 3NO2 + 3H2O
A l'aide d'une pince en bois y plonger la moitié inférieure d'un clou pendant quelques secondes.
On observe l'attaque rapide du fer, la solution prend une teinte rouille (Fe3+) et d'abondantes
vapeurs rousses (NO2) se forment. Retirer le clou et le rincer dans un bécher d'eau. Garder le
clou.

I.1.2.2 Action de l'acide nitrique fumant sur le fer :
Procéder exactement de la même manière que précédemment. Fer + acide nitrique oxyde de
fer. Quand le clou entre en contact avec l'acide fumant l'attaque à lieu mais elle s'arrête presque
immédiatement. Retirer le clou et comparer son aspect avec le précédant. On constate qu'il prend
un aspect très brillant (presque argenté). L'oxydation à produit ici une pellicule d'oxyde
magnétique de fer Fe3O4 qui protège le fer et la réaction s'arrête, c'est le phénomène de
passivation. Montrer cette protection en replongeant le clou dans l'acide dilué, l'attaque n'a plus
lieu. On peut montrer la fragilité de cette protection, il suffit de percer la pellicule d'oxyde en
touchant le clou avec une baguette de verre ou un fil métallique pour que l'attaque reprenne
immédiatement. (il se produit un phénomène de micro-pile ). Cette passivation permet le transport
de l'acide nitrique fumant dans des fûts de fer.
I.2 Oxydation de fer en ions tétraoxoferrate VI
100 Manip n°58.2 p.167
Nous avons vu le passage de l’état d’oxydation 0 aux état 2 et 3. Nous allons
voir ici le passage au degré d’oxydation ultime du fer : le niveau VI.
Protocole : Electrolysons une solution de soude à 10 mol.L-1 (cathode en
graphite et anode : clou de fer décapé) sous 6V pendant 10 minutes.
Observations : un anneau rose (caractéristique des ions tétraoxoferrate)
se développe autour de l’anode en fer et des dégagement gazeux
apparaissent autour des 2 électrodes (électrolyse de l’eau)
équations de la réaction à l’anode : Fe(s) + 8 HO- FeO42- + 4H2O + 6 e-
II. Les ions du fer
Les principaux ions du fer que l’on retrouve en solution sont les ions fer II et fer III. Nous avons
souvent besoin d’identifier les ions présents en solution pour vérifier, par exemple, les produits
d’une réaction. Plusieurs tests sont possibles avec les ions fer II et fer III.
II.1 Caractérisation
II.1.1 par un précipité
100 Manip n°1 p.60
Solution de fer II = sel de Mohr – couleur incolore – 0,1 mol.L-1
Solution de fer III = FeCl3 (chlorure de fer III) – jaune – 0,1 mol.L-1
Protocole : dans 2 tubes à essais contenant chacune des solutions, verser quelques gouttes
de soude (1 mol.L-1)
Observations : précipité vert avec les ions fer II : Fe2+ + HO- = Fe(OH)2(s)
précipité rouille avec les ions fer III : Fe3+ + HO- = Fe(OH)3(s)
II.1.2 Caractérisation par un complexe
100 Manip n°1 p.61
II.1.2.1 Avec l’orthophénantroline
fer II : Fe2+ + 3Ophen = [Fe(Ophen)3]2+ complexe rouge
fer III : Fe3+ + 3Ophen = [Fe(Ophen)3]3+ complexe bleu pale
II.1.2.2 Avec le thiocyanate
fer III : Fe3+ + SCN- = [Fe(SCN)]2+ complexe rouge sang
II.2 Propriétés acido-basiques
Protocole :
dans 2 béchers, mettre une solution de sel de Mohr (Fe2+) (solide + H2O). Dans 2 autres
béchers, une solution de nitrate ferrique (Fe3+)(solide + H2O)
ajouter de BBT dans un bécher de fer II et dans une de fer III. Les 2 solutions sont jaunes.
Interprétation : le pH des 2 solutions est inférieur à 6 (pH<6 : BBT jaune ; pH>7,6 : BBT bleu)
ajouter du bleu de thymol dans un bécher de fer II et dans une de fer III. La solution de sel
de Mohr est jaune, celle de nitrate ferrique est rose
Interprétation : le pH de la solution de sel de Mohr est > 2,8, celui de la solution de fer III est <
1,2 (pH<1,2 : bleu de thymol rose ; pH>2,8 : bleu de thymol jaune)
+
-

Pourquoi les ions Fe2+ et Fe3+ ont-ils un comportement acide en solution ? car en solution,
ils forment des complexes avec l’eau, qui peut se dissocier en libérant un proton.
[Fe(H2O)6]3+ + H2O = [Fe(H2O)5]2+ + H3O+ pKa=2,2
[Fe(H2O)6]2+ + H2O = [Fe(H2O)4]+ + H3O+ pKa=3,2
II.3 Propriétés catalytiques
100 Manip n°79 p.199
Protocole : dans le bécher n°1, mettre 15 mL de KI (1 mol.L-1)
Dans le bécher n°2, mettre 15mL de KI (1 mol.L-1) + 1mL de sel de Mohr 0,1 mol.L-1
Les 2 béchers sont sous agitation
Ajouter en même temps dans les 2 béchers, 5 mL de Na2S2O8 (0,1 mol.L-1)
observation : la décoloration est plus rapide avec les ions fer II : il sont catalyseurs de la
réaction.
équation de la réaction : S2O82- + 3I- 2 SO42- + I3-
E°( S2O82-/ SO42-)=2,00 V
E°(Fe3+/Fe2+) = 0,77 V
E°(I3-/I-) = 0,54 V
II.4 Propriétés rédox : dosage des ions fer II par le cérium IV
Le maréchal T2 p. 259 - Le maréchal p. 149 - Sarrazin 1.5/5 p.87 ou 100 manip
Protocole :
10 mL de solution de sel de Mohr acidifiée à 0,1 mol.L-1 + 1 goutte d’orthophénantroline ferreuse.
La solution est rouge.
Doser par une solution de nitrate de cérium de même concentration. L’équivalence est déterminée
par le changement de couleur de la solution qui passe du rouge au vert (clair). Faire des témoins
car la couleur bleu claire n’est pas franche.
Rq : si on fait le dosage par potentiométrie, on récupère en plus la valeur des potentiels des couples. Mais le dosage
colorimétrique rappelle ce qu’on a fait dans le paragraphe caractérisation
Equation de la réaction : Fe2+ + Ce4+ Fe3+ + Ce3+
E°( Ce4+/ Ce3+)=1,74 V
E°( [Fe(Ophen)3]3+/ [Fe(Ophen)3]2+)=1,14 V
E°(Fe3+/Fe2+) = 0,77 V
Conclusion
Nous avons vu dans ce montage, l’élément fer sous ses différentes formes : Fe, Fe2+, Fe3+,
Fe(OH)2, Fe(OH)3, FeO42-, et les passages d’une forme à l’autre. Le fer a des propriété redox,
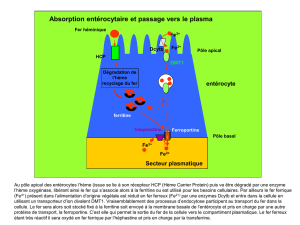
mais aussi acido-basique, il ne faut pas l’oublier. L'hémoglobine du sang, qui permet aux globules
rouges de transporter le dioxygène, contient du fer.
BIBLIO
Souil T1
La chimie expérimentale – T2 : chimie orga et minérale – Barbe/Le Maréchal [1]
100 manip
Sarrazin (potentiels std + corrosion)
Le Maréchal
Questions
Q1 : Structure électronique du fer ?
R2 : Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2 degré d’oxydation 0
Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d6 degré d’oxydation +II
Fe3+ : 1s2 2s2 2p6 3s2 3p6 3d5 degré d’oxydation +III
Q2 : qu’est-ce que la rouille ?

R2 : Laissé à l'air libre en présence d'humidité, le fer se corrode en formant de la rouille. La rouille
étant un matériau poreux, la réaction d'oxydation peut se propager jusqu'au cœur du métal,
contrairement, par exemple, à l'aluminium, qui forme une couche fine d'oxyde imperméable.
Q3 : de quoi est recouvert le fer après avoir été plongé dans l’acide nitrique fumant ?
R3 : de la magnétite : Fe3O4 – le fer est au nombre d’oxydation III et II
Q4 : que se passe t-il si on diminue le pH d’une solution de fer VI ?
R4 : le fer VI n’est stable qu’en milieu alcalin. Si on diminue le pH, on aura le fer III au lieu du fer
VI
Q5 : quel autre métal est acide en solution ?
R5 : le cuivre
Q6 : principe de l’électrolyse
R6 : oxydation à l’anode, réduction à la cathode. On applique une ddp entre les 2 électrodes. Ce
processus n’est pas spontané.
Q7 : quel est l’avantage du titrage potentiométrique par rapport au titrage colorimétrique ?
R7 : permet de trouver la concentration initiale en fe2+ et permet de déterminer le potentiel du
couple dosé (à la ½ équivalence) et du couple de la solution titrante (à la double
équivalence).
Q8 : comment calculer le potentiel à l’équivalence ?
R8 : avant l’équivalence : on ajoute Ce4+ qui réagit avec Fe2+ pour donner Fe3+ et Ce3+. On n’a
plus de Ce4+ en solution. Il est très difficile de calculer E(Ce4+/Ce3+). C’est donc le couple
(Fe3+/Fe2+) qui impose son potentiel
A l’équivalence, E= ½ (E(Ce4+/Ce3+)+ E(Fe3+/Fe2+)
Q9 : qu’est-ce qu’un tampon rédox ?
R9 : à la ½ équivalence, on a une zone d’inflexion : on a un tampon
Q10 : dans quel dosage particulier intervient le complexe coloré [Fe(SCN)]2+ ?
R10 : dans le dosage des ions chlorure par la méthode de Charpentier Vohlard. Il s’agit d’un
dosage en retour (on dose l’excès de réactif). On verse un excès de nitrate d’argent dans la
solution contenant les ions chlorure (on a un précipité d’AgCl). Puis, l’excès d’ions argent est
dosé par du thiocyanate de potassium (le précipité de AgSCN est moins soluble que celui
de AgCl). Lorsqu’il n’y a plus d’ions argent en solution, il y a réaction de l’indicateur coloré
(Fe3+) avec SCN- pour former un complexe rouge.
Q11 : quel est l’inconvénient de cette méthode ?
R11 : le complexe rouge peut apparaître et disparaître (décoloration partielle) car il peut y avoir
une réaction entre le précipité + stable et le précipité le – stable. La quantité de complexe
diminue donc car il réagit avec AgCl : AgCl(s) + [Fe(SCN)]2+ Fe3+ + AgSCN(s) + Cl-
Q12 : quel complexe peut on former entre le fer et les ions cyanure ?
R12 : bleu de turnebulle (caractérisation des ions fer II) : c’est un sel complexe constitué du
complexe octaédrique ferIIICN- (le ferIII est l’ion coordinateur) et de Fe2+
Q13 : théorie du champ cristallin
R13 : structure de fe2+ : [Ar]3d6 donc
Lorsque le ligand est à champ faible, il est paramagnétique, mais lorsque le ligand est à
champ fort, il est diamagnétique (normalement, il y a levée de dégénérescence des orbitale : 3

sont sur un niveau inférieur et 2 à un niveau supérieur (schéma suivant non représentatif de la
réalité, mais plus simple à faire…)
Par contre, pour le fer III, fe3+ : [Ar]3d5 et toujours paramagnétique, quel que soit le type de
ligand.
Q14 : principe de la catalyse ?
R14 : le catalyseur augmente la vitesse d’une réaction thermodynamiquement faisable en
diminuant l’énergie d’activation, mais sans intervenir dans l’équation de la réaction.
Q15 : autre réaction catalysée par le fer ?
R15 : la dismutation du peroxyde d’hydrogène (par Fe2+), la synthèse industrielle de l’ammoniac à
partir de N2 et H2 (catalysée per Fe, Al2O3 et K2O)
Q16 : comment peut-on passer d’un oxyde de fer à un autre ?
R16 : avec H2 à haute température : Fe3O4(s) + H2(g) 3FeO(s) + H2O(g) à 500°C
1
/
5
100%