Correction_compo_1

Partie Physique
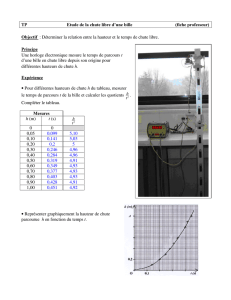
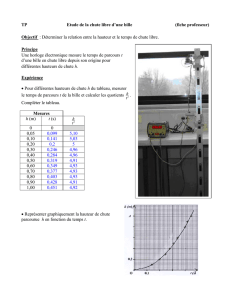
1.1. Calculer la valeur de la vitesse instantanée aux points indiqués dans le tableau fourni en annexe.
v1B0B2
2
A.N :
v11,2.1024
20,010
2,4 m.s-1.
1.2. Tracer les vecteurs vitesse du centre d’inertie la bille aux points B1 , B4 et B7 sur la figure 4 en annexe.
D’après le principe d’inertie, la bille accélère
1.3. Que peut-on dire des forces exercées sur la bille entre B0 et B7 ?
La bille accélère donc, d’après le principe d’inertie, la somme des forces n’est pas nulle.
1.4. Quelle relation lie la vitesse linéaire du point B et la vitesse de rotation du bras de la catapulte autour de son
axe ?
vB
.RB
1.5. Déterminer la vitesse de rotation du bras de la catapulte lorsque la bille est aux points indiqués dans le
tableau fourni en annexe..
vB
.RB
donc :
vB
RB
1vB,1
RB
A.N :
12,4
0,22
=11 rad.s-1
1.6. Le mouvement de rotation du bras est-il uniforme ? Justifier la réponse.
La vitesse de rotation augmente donc le mouvement de rotation n’est pas uniforme.
1.7. Pour modéliser la vitesse de rotation du bras au cours du temps entre B1 et B5, on propose la relation
suivante :
a.t
+b
Montrer que cette relation rend bien compte des résultats expérimentaux et déterminer a.
Il manquait dans l’énoncé la constante b :
Traçons graphiquement la vitesse angulaire en fonction du temps :
Les points expérimentaux s’alignent sur une droite qui ne passe pas par
l’origine.
La relation proposée rend bien compte des résultats expérimentaux si on tient
compte de l’ordonnée à l’origine.
Ainsi,
a.tb
avec a le coefficient directeur de la droite.
On calcule a = 0,33 rad.ms-2.
1.8. En déduire la relation donnant la vitesse instantanée du point B au cours
du temps entre B1 et B5.
vR.a.t
avec l’expression de l’énoncé, ou
vRa.tb
avec l’expression corrigée.
2. Mouvement de la bille après libération.
2.1. Montrer que la vitesse de la bille au point B16 vaut
v16
4,4 m.s-1.
0
5
10
15
20
25
020 40 60
Série2

v16 B15 B17
2
A.N :
v12,2.1024
20,010
4,4 m.s-1.
2.2. Tracer le vecteur vitesse
v16
de la bille.
Avec l’échelle de vitesse choisie précédemment, le vecteur est représenté par un segment fléché de 4,4 cm.
2.3. Faire l’inventaire des forces exercées sur la bille dans cette phase du mouvement.
Les forces exercées sont :
- le poids vertical orienté vers le bas de norme P = m.g
- la poussée d’Archimède verticale orientée vers le haut de norme A = mair.g
- le frottement de l’air orienté dans le sens contraire au mouvement et de norme f.
2.4. La poussée d’Archimède de l’air sur la bille est-elle négligeable comparée au poids de la bille ?
On compare P et A :
P
A
bille.Vbille.g
air.Vbille.g
donc
P
A
bille
air
A.N :
P
A
bille
air
= 6,9.102 .
Donc P est 700 fois plus grand que A : La poussée d’Archimède est négligeable.
2.5. Montrer que la seule force à retenir agissant sur la bille est le poids.
On compare P et f pour la vitesse maximale de la bille :
P
f
bille.Vbille.g
k.vmax
A.N :
P
f9,0.1024
33,141,0.102
39,81
1,0.1055
= 7,4.102.
Donc P est 700 fois plus grand que f : Le frottement de l’air est négligeable.
La seule force à prendre en compte est donc le poids.
3. Equilibre du bras de la catapulte.
3.1. Indiquer quelle est l’action mécanique représentée par chacune de ces forces en justifiant le sens des forces
F2
et
F4
.
F1 : action du support sur le bras ;
F2 : action de l’élastique sur le bras. du bras vers l’élastique car l’élastique tire le bras.
F3 : action de la Terre sur le bras.
F4 : action de la ficelle sur le bras. Vers le bas, car empêche le bras de partir vers le haut.
F1
F2
F3
F4

3.2. Déterminer la valeur de la force
F2
.
F2 = k.x A.N : F2 = 5,0 N.
3.3. Quelle relation peut-on écrire entre ces forces ?
D’après le principe d’inertie, le bras de la catapulte est immobile donc la somme des forces est nulle
F1F2F3F40
3.3. Sur quel axe faut-il projeter les forces pour déterminer la valeur de F4 en fonction des données du problème.
La force F1 n’est pas connue : il faut projeter les forces sur un axe perpendiculaire à F1 pour se débarrasser de
celle-ci.
3.4. Projeter la relation vectorielle établie au 3.2. sur l’axe choisi.
Sur un axe perpendiculaire à F1 orienté vers le haut :
0F2cos
F3sin
F4sin
0
3.5. Déterminer F4.
F2cos
mgsin
F4sin
0
soit
F4F2cos
sin
mg
A.N : F4 = 18 N
PARTIE CHIMIE
1. Déterminer le volume VCl2 de dichlore nécessaire à la préparation du berlingot d'eau de Javel. (1 pt)
Tableau de proportionnalité : (0,5pt)
Volume de dichlore (L)
48
VCl2
Volume d'eau de javel
1
0,25
Soit : VCl2 = 48X0,25 = 12 L de dichlore (0,5 pt)
2. Les réactifs étant introduits dans les proportions stoechiométriques, en déduire l’avancement maximal de la
transformation. (1 pt)
Le dichlore est entièrement consommé, donc : n iCl2-xmax=0 soit xmax = n iCl2 (0,5)
Or nCl2 = VCl2 / Vm donc : xmax = 0,54 mol. (0,5)
3. Dresser le tableau d’avancement de la transformation et déterminer l’état final de la transformation (l’eau est
le solvant et sera notée en excès). (1,5 pts)
Etat
Avancement
(mol)
Cl2(g) + 2HO- (aq) → ClO-(aq) + Cl- (aq) + H2O (l)
Initial
0
n iCl2
n iHO-
0
0
bcp
Intermédiaire
x
n iCl2-x
n iHO--2x
x
x
bcp
Final
xmax
= 0,54
n iCl2-xmax
= 0
n iHO--2xmax
= 0
xmax
= 0,54
xmax
= 0,54
bcp
4. Déterminer les concentrations molaires des ions hypochlorite
ClO
et chlorure
Cl
dans le berlingot. (1,5
pts)

ClO-] = [Cl-] = nCl2 / V0 or nCl2 = VCl2 / Vm
D'où : [ClO-] = [Cl-] = VCl2 / (Vm.V0 ) (1 pt)
AN : [ClO-] = [Cl-] = 12 / (0,25X22,4) = 2,1 mol.L-1 (0,5 pt)
5. Montrer que la concentration des ions sodium dans le berlingot d’eau de Javel est
Na
0
4,2 mol.L-1. (1,5
pts)
Une solution ionique doit être électriquement neutre. Il doit donc y avoir autant de charges électriques positives
que de charges électriques négatives.
Par conséquent :
n(Na)0n(ClO)0n(Cl)0
(1 pt)
Donc :
Na
0ClO
0Cl
0
A.N :
Na
0
4,2 mol.L-1 (0,5 pt)
6. Quelle est la formule statistique du solide ionique dichromate de sodium ? (1,5 pts)
Le dichromate de sodium solide est constitué des ions
Cr2O7
2
et des ions
Na
.
Or le solide ionique doit être électriquement neutre. (1 pt)
Par conséquent sa formule statistique doit indiquer deux fois plus d’ions sodium que d’ions dichromate :
Na2Cr2O7
(0,5 pt)
7. Ecrire l'équation de dissolution du dichromate de sodium. (1 pt)
Na2Cr2O7(s)
Cr2O7(aq)
22Na(aq)
8. Déterminer la concentration des ions sodium
Na
1
dans la solution S1. (2,5 pts)
La dissolution du dichromate de potassium apporte une quantité de matière d’ions sodium
n(Na)d2nK2Cr2O7
d’après l’équation de dissolution. (0,5 pt)
Donc, la quantité de matière d’ions sodium dans la solution S1 est :
n(Na)1n(Na)0n(Na)dn(Na)02nK2Cr2O7
(0,5 pt)
Par conséquent :
Na
1n(Na)02nK2Cr2O7
V0
donc
Na
1Na
02nK2Cr2O7
V0
(0,5 pt)
Or
nK2Cr2O7md
Md
donc :
Na
1Na
02md
V0Md
(0,5 pt)
A.N :
Na
14,2210,0
0,250262
4,5 mol.L-1 (0,5 pt)
9. Justifier le degré chlorométrique de la solution S1 d’eau de Javel. (1 pt)
Proportionnalité : (0,5pt)
°Chl
12
48
Volume (L)
1
0,25
Coefficient de proportionnalité : 4 donc un facteur de dilution F = 4 (0,5pt)
10. Quelles sont les concentrations molaires des ions
ClO
,
Cl
et
Na
dans la solution S2 ? (1 pt)
Les ions sont quatre fois moins concentrés dans la solution diluée, donc : (0,5 pt)

Na
2
1,1 mol.L-1
ClO
2
0,52 mol.L-1
Cl
2
0,52 mol.L-1 (0,5 pt)
Exercice 2 (6,5 points)
1. La solution de chlorure de potassium Lavoisier® est obtenue par dissolution de chlorure de potassium
solide KCl(s). Écrire l'équation de dissolution de KCl(s). (0,5 pt)
KCl(s)K(aq)
Cl(aq)
2. Schématiser le montage électrique permettant de déterminer la conductance G d’une solution. (1 pt)
3. Tracer la courbe G = f(C) (2 pts)
échelle de représentation :
1 cm ↔ 1 mmol/L
1 cm ↔ 0,5 mS
4. Déterminer la relation liant la conductance G à la concentration C en soluté apporté du chlorure de
potassium. (1 pt)
Les points expérimentaux s’alignent sur une droite, donc on peut écrire :
Gk.C
où k est le coefficient directeur de la droite. (0,5 pt)
Donc :
k2,00,30
7,01,0
0,28 mS.mmol-1.L soit
G0,28C
(0,5 pt)
5. Quelle est la concentration Cd ? Indiquer la méthode utilisée. (0,5 pt)
On reporte Gd en ordonnée sur le graphique et on lit l'abscisse Cd correspondante grâce à G = f(Ci). ( 0,25 pt)
Graphique : 2 pts
Flèche sur axe
0,5
Grandeur et unité
sur axe
0,5
Tracé courbe
0,5
Echelle de
représentation
0,5
G=f(C)
0
0,5
1
1,5
2
2,5
0 2 4 6 8 10
C (mmol/L)
G (mS)
G
A
V
 6
6
 7
7
1
/
7
100%