AB extraire identifier synthétiser

C. Guibal – Bellevue TS spé chimie- A et B. Extraire, identifier et Synthèse 1/5
Partie AB: EXTRAIRE, IDENTIFIER et SYNTHETISER les espèces chimiques
Les savoir-faire
Réaliser une chromatographie par une technique donnée (couche mince, papier ou colonne).
Animation Flash Chromatographie I.Tarride&J.C.Desarnaud
Exploiter un chromatogramme.
Réaliser une extraction liquide-liquide. Animation Flash I.Tarride&J.C.Desarnaud
Commenter un montage expérimental et connaître le nom des montages.
Choisir la verrerie appropriée pour réaliser une manipulation en disposant du protocole
expérimental et d'une liste de matériel et de produits disponibles.
1- INTRODUCTION : rôle du chimiste
Pour se nourrir, pour se soigner, l’homme a appris à exploiter les trésors cachés dans la nature. Par
la suite, au lieu d’utiliser une tisane de plante, il a préféré chercher quel était le principe actif
(entité chimique, molécule responsable de l’action de la plante) présent dans la plante et le « copier ».
Pour cela, il a fallu
extraire au mieux les molécules de la plante, les séparer, puis les identifier
(analyse qualitative) une par une : ceci est de la chimie analytique : travail de l’analyste.
(partie A du programme)
Si une assez grande quantité (analyse quantitative : dosages vus en tronc commun et dans
la partie C) peut être isolée alors chaque molécule peut être testée de façon à évaluer son
action : ceci est le fruit d’un travail en équipe avec des biologistes.
Enfin, les molécules intéressantes sont « copiées » puis purifiées : c’est la synthèse
organique : travail du chimiste organisien. (partie B du programme)
Le travail du chimiste peut être classé par types d’activités dont certaines ont déjà été recensées au
collège et au lycée :
Le chimiste doit savoir extraire, séparer, analyser et identifier des espèces chimiques.
Le chimiste doit savoir créer et reproduire des espèces chimiques.
Le chimiste doit savoir purifier ces espèces.
Le chimiste doit savoir protéger certains matériaux.
Le chimiste doit savoir effectuer des contrôles de qualité.
Il faut noter l'extraordinaire pouvoir inventif des chimistes qui créent, chaque jour, des centaines
d'espèces nouvelles dans des domaines allant des matériaux lourds à la pharmacologie.
2- PRE-REQUIS : notion de polarité vue en 1ère S
Les techniques d’extraction et de séparation sont basées sur les différences d’affinités qu’a une molécule
(celle que l’on veut extraire) vis-à-vis de tel ou tel solvant. Pour optimiser ces techniques, le chimiste va
jouer sur les différences de solubilités elles-mêmes dépendantes de la polarité des molécules et des
solvants choisis. Afin de bien comprendre ces techniques, il est indispensable de se souvenir comment se
détermine la polarité d’une molécule. Pour qu’une molécule soit polaire, il faut que :
La molécule doit posséder au moins une liaison polarisée (les deux atomes liés doivent être de nature
différente et d’électronégativité différente : un élément chimique est d’autant plus électronégatif qu’il est
placé en haut et à droite du tableau périodique)
La géométrie de la molécule doit induire que le "barycentre" des charges négatives soit distinct du
"barycentre" des charges positives.

C. Guibal – Bellevue TS spé chimie- A et B. Extraire, identifier et Synthèse 2/5
3- EXTRACTION
3- 1 Extraction par macération
La macération consiste à faire tremper un échantillon (feuille, plante, fruit…) dans un
solvant (froid ou chaud) pour extraire les espèces solubles dans le solvant utilisé.
3- 2 Extraction par hydrodistillation
Pour la réaliser, le montage nécessaire
ressemble à celui d’un montage à
distiller sauf qu’il n’a pas de colonne à
distiller. Cette technique a été utilisée
en classe pour l’extraction de l’huile
essentielle de lavande. Le réfrigérant
permet de condenser les vapeurs
formées au cours de l’ébullition. Au
contact de la paroi froide du
réfrigérant, les vapeurs se condensent :
des gouttelettes coulent alors dans le
réfrigérant et tombent dans
l’erlenmeyer.
Une hydrodistillation est un entraînement à la vapeur d’eau. L’hydrodistillat est donc un
mélange hétérogène d’eau et d’un liquide organique (par exemple une huile essentielle, elle-même
constituée d’une centaine d’entités chimiques différentes). Cette technique est choisie lorsqu’on
désire extraire d’une substance naturelle, un liquide non miscible à l’eau.
4- SEPARATION
4- 1 Filtration
Cette technique permet de séparer un solide d’un liquide. Elle peut se réaliser plus rapidement si
on se place sous vide. Le dispositif de filtration sous vide comporte un filtre Büchner (ou un verre fritté)
installé sur une fiole à vide reliée à une trompe à eau. L’aspiration
crée par la trompe à eau oblige le liquide à passer dans la fiole à
vide.
réfrigérant à eau
chauffe-ballon
feuilles de menthe,
eau et pierre ponce
ballon
distillat
erlenmeyer
thermomètre
1
2

C. Guibal – Bellevue TS spé chimie- A et B. Extraire, identifier et Synthèse 3/5
4- 2 Décantation et extraction liquide-liquide
Cette technique permet de séparer deux liquides non miscibles, de densité différente, à
l’aide d’une ampoule à décanter. Animation Flash I.Tarride&J.C.Desarnaud
A la suite d’une synthèse ou d’une extraction par hydrodistillation, nous avons vu que l’on obtenait un
mélange hétérogène : mélange de deux liquides non miscibles, l’un organique (non polaire), l’autre
aqueux (polaire). Pour séparer ces deux phases, il suffit de laisser décanter (temps de repos).
La phase la plus lourde (densité la plus élevée) sera dans la partie inférieure. Celle-ci peut être recueillie
grâce à un robinet situé à l’extrémité de l’ampoule.
Selon les situations, l’entité chimique que l’on désire isoler se
situera dans l’une ou l’autre phase. Quand elle sera dans la phase
organique, il faudra choisir judicieusement le solvant organique de
façon à ce que la solubilité de l’entité soit la plus grande. Parfois,
pour favoriser le passage de l’entité dans la phase organique, on
procède au « relargage ». Cela consiste à ajouter du chlorure de
sodium (sel) dans l’ampoule. Tout se passe comme si le sel
(composé ionique donc très polaire) prenait la place des quelques
entités peu polaires encore présentes dans la phase aqueuse.
Il faudra aussi penser à l’étape suivante qui consiste à éliminer le solvant par distillation (montage à
distiller ou évaporateur rotatif), il faudra donc que le solvant ait une température d’ébullition basse.
Avant d’être distillée, ce solvant ne doit plus contenir d’eau, il devra être « séché ». Le « séchage » d’un
liquide organique s’effectue à l’aide de chlorure de calcium (CaCl2) sulfate de sodium (Na2SO4) ou de
magnésium (MgSO4) anhydre. Voir le sujet : Métropole 09/2008 Ex III. : SIROP DE MENTHE
Cet exemple montre bien que le dichlorométhane, comme solvant extracteur, vérifie ces deux propriétés :
Le solvant extracteur doit être non miscible avec l’eau salée.
D’autre part, l’huile essentielle de menthe doit être très soluble dans le solvant extracteur.
De plus, le dichlorométhane possède une température d’ébullition peu élevée, ce qui
permet de l’évaporer facilement.
4- 3 Distillation
La distillation fractionnée permet de séparer les constituants d’un
mélange homogène (liquides miscibles) ayant des températures d’ébullition
différentes. Le montage nécessaire est un montage à distiller. Il comporte
principalement une colonne à distiller (colonne de Vigreux). La température en
tête de colonne est suivie. L’espèce qui sera distillée en premier sera la plus
volatile, c'est-à-dire celle qui présente la température d’ébullition la plus basse. A
chaque substance distillée, caractérisée par sa température d’ébullition, on
observera un « palier de température ». Ainsi, différentes fractions (distillat ne
contenant qu’une seule substance pure) seront recueillies au cours de la distillation
4- 4 Chromatographie
La chromatographie sur couche mince (CCM) est une méthode permettant de séparer les espèces
chimiques d’un mélange et de les identifier. Le principe est basé sur la différence d’affinité (de solubilité)
d’une espèce chimique dans deux phases non miscibles : la phase fixe liée au support et la phase mobile.
Plus la substance est soluble dans la phase mobile, plus elle migre avec elle. La phase mobile s’élève le
long de la phase fixe par capillarité : c’est le phénomène d’élution. On dit que la phase mobile est un
éluant.
On distingue différentes chromatographies, toutes basées sur le même principe. On qualifie
Phase organique :
huile essentielle de
menthe
+
dichlorométhane
Phase aqueuse :
eau salée
+
eaux aromatiques

C. Guibal – Bellevue TS spé chimie- A et B. Extraire, identifier et Synthèse 4/5
de chromatographie de partage : la chromatographie sur papier. La phase stationnaire est alors
l’eau liée aux molécules de cellulose du papier.
de chromatographie d’adsorption : La chromatographie sur couche mince (CCM) et la
chromatographie sur colonne : la phase stationnaire est un solide (silice ou alumine).
Réalisation d’une CCM :
http://www.spc.ac-aix-marseille.fr/phy_chi/Menu/Activites_pedagogiques/cap_exp/animations/ccm.swf
On trace à environ 1 cm du bas un trait au crayon de papier : ceci est la ligne de dépôt. On place
plusieurs points sur cette ligne où seront déposés les échantillons à l’aide d’un capillaire ou d’une
petite pointe. On sèche rapidement avec un sèche-cheveux.
La plaque CCM est placée délicatement dans une cuve (récipient fermé dans lequel on a versé un fond
d’éluant (< 1 cm) et que l’on a laissé équilibré (phase liquide et phase vapeur) au moins ¼ d’heure).
Quand l’élution est terminée, on note la limite du front du solvant et on observe les taches obtenues.
Révélation : Si les taches ne sont pas colorées naturellement, elles peuvent être rendues visibles par
différentes méthodes : révélation aux UV ou révélation après pulvérisation d’un réactif adapté permettant
d’obtenir des taches colorées.
On détermine la valeur du rapport frontal Rf pour chaque espèce chimique.
Rf = distance parcourue par l’espèce chimique/distance parcourue par le front de l’éluant
Cas particulier : une solution peut contenir d’autres substances (sucres) qui gênent la réalisation d’une
chromatographie. Exemple d’une analyse par chromatographie d’un sirop de menthe :
On ne peut pas réaliser directement la chromatographie du sirop de menthe à cause de la présence des sucres.
On procède alors en deux étapes.
Étape 1 : extraction des colorants.
Des brins de laine écrue (c'est-à-dire non teintée) sont trempés dans une solution d’ammoniac pendant quelques
minutes puis ils sont rincés et séchés. Ils sont ensuite placés dans
un bécher contenant du sirop de menthe. Les colorants contenus
dans le sirop se fixent, à chaud et en présence d’acide éthanoïque,
sur les brins de laine. Après rinçage et essorage, les brins de laine
teints en vert sont placés dans une solution d’ammoniac où ils se
décolorent. La solution verte obtenue est portée à ébullition afin de
la concentrer par évaporation d’eau. Cette solution est ensuite
analysée par chromatographie.
Étape 2 : chromatographie.
Sur un papier filtre, on réalise les trois dépôts suivants :
- colorant alimentaire E102 (tartrazine)
- colorant alimentaire E131 (bleu patenté V)
- solution verte obtenue S
L’éluant utilisé est une solution de chlorure de sodium de
concentration égale à 20 g.L – 1 .
Le chromatogramme obtenu est schématisé ci-contre.
5- PURIFICATION
5- 1 Recristallisation
La recristallisation permet de purifier une substance solide en jouant sur les différences
de solubilités à chaud et/ou à froid de la substance à purifier et des impuretés. Il faut
choisir un solvant dans lequel le solide à purifier n’est soluble qu’à chaud alors que les impuretés doivent
être solubles à chaud et à froid. Il suffit de dissoudre l’ensemble à chaud. Puis, en refroidissant la solution
obtenue, la substance désirée recristallise alors que les impuretés restent solubilisées dans le solvant. Il ne
reste plus qu’à éliminer ces impuretés en séparant le solide du solvant par une simple filtration. Avant de
peser la masse obtenue, il faudra « sécher » le solide en le passant à l’étuve (four dont on peut régler
précisément la température) afin d’éliminer les dernières traces de solvant.
E102 E131 S
tache bleue
tache jaune
–

C. Guibal – Bellevue TS spé chimie- A et B. Extraire, identifier et Synthèse 5/5
5- 2 Distillation
Cette technique vue plus haut est également une méthode pour purifier lorsque la substance est liquide et
que sa température d’ébullition est connue (pas trop haute tout de même). Il suffira d’attendre d’atteindre
le palier de température correspondant et de recueillir la fraction correspondante pendant le palier.
6- SYNTHESE organique
Les savoir-faire
Réaliser les opérations suivantes: chauffage à reflux, distillation, lavage d'une phase organique,
séchage d'une phase organique liquide, extraction liquide-liquide, séchage d'un solide,
cristallisation, recristallisation.
Appliquer les consignes de sécurité.
Justifier les opérations d'un protocole à partir de données physico-chimiques (température de
changement d'état, solubilité, pH, densité.)
Calculer un rendement.
Reconnaître les groupes caractéristiques alcool, aldéhyde, cétone, acide carboxylique, anhydride
d’acide, chlorure d’acyle, ester, amine et amide.
6- 1 Montage expérimental
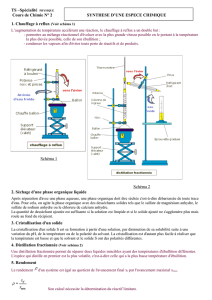
Bien souvent, pour réaliser une transformation chimique, il est nécessaire de chauffer
le mélange réactionnel. En effet, les réactifs doivent être en solution pour rentrer en
contact. Si les réactifs sont solides, il faut alors les dissoudre dans un solvant. En
chauffant, on augmente la solubilité.
Par ailleurs, la température étant un facteur cinétique, la réaction chimique sera plus
rapide à température plus élevée.
Le montage qui permet d’accélérer une réaction sans perte de matière est le
chauffage à reflux : ballon surmonté d’un réfrigérant à boule qui assure la
condensation des vapeurs .
.
6- 2 Synthèse de molécules organiques
Synthèse d’un ester
Synthèse d’un amide
6- 3 Rendement : η
Le rendement permet d’évaluer « l’efficacité » de la réaction chimique. Il se
calcule en faisant le rapport de la masse maximale de produit désiré que l’on
obtiendrait si la réaction était totale (calcul théorique à partir de la quantité de
matière du réactif limitant) sur la masse réellement obtenue.
1
/
5
100%