Chap2

Chap 2 : Comment accumuler de l'énergie ?
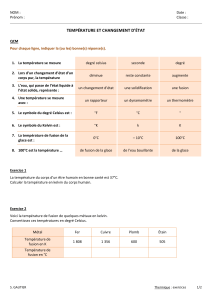
I- Mesurer une température
1- Les différents thermomètres
Pour relever une température, on utilise un thermomètre à alcool ou un électronique.
Ils sont gradués en degré Celsius (°C).
2- Température et agitation
Les molécules d'un gaz sont en perpétuel mouvement, animés de vitesses de plusieurs centaines de
mètres par seconde.
De même les atomes, molécules, ions constituant les liquides et les solides ne sont pas immobiles mais
en perpétuel mouvement.
Lorsqu'on chauffe un corps, on augmente l'agitation des particules qui le constituent et sa
température s'élève.
Lorsqu'on le refroidit, on diminue cette agitation et sa température diminue.
Si on le refroidit suffisamment, ses particules sont alors immobiles et on atteint la température la
plus basse que l'on puisse obtenir
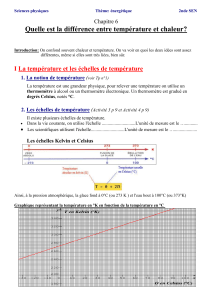
3- Les 2 échelles de température
Dans l'échelle Celsius, on a fixé la température du mélange eau-glace (température de fusion) à 0°C
et celle du mélange eau-vapeur (température de vaporisation) à 100°C.
Il existe en théorie une température basse limite qui correspond à l'absence d'agitation thermique,
c'est le zéro absolu 0 Kelvin.
La température absolue, notée T, s'exprime en kelvin, K. Elle est liée à la température, θ exprimée
en degré Celsius °C, par : T = θ + 273
II- Transferts d'énergie et énergie interne
1- Énergie interne
Les particules constituant un corps sont agitées. Elles possèdent donc une énergie cinétique.
Elles interagissent entre elles : elles sont liées par des liaisons chimiques et s’attirent par des
forces électriques, elles possèdent donc une énergie appelée énergie potentielle d'interaction.
La somme de l'énergie cinétique de l'agitation des particules et de l'énergie potentielle d'interaction
de ces particules est appelée énergie interne notée U.
2- Énergie thermique
Lorsqu'on chauffe un corps on augmente l'agitation thermique et donc son énergie interne.
La quantité de chaleur, Q, que le corps, solide, liquide ou gaz, reçoit est stockée sous forme
d'énergie interne.
La variation d'énergie interne DU, est égale à la quantité de chaleur reçue : Q= DU en Joule.
Si on chauffe l'eau alors DU augmente et si on refroidit l'eau alors DU diminue.
3- Comment modifier l'énergie interne d'un corps ?
On peut modifier l'énergie interne d'un corps en lui transférant :
–de la chaleur (chauffage) ;
–du mouvement (forces de frottements) ;
–de la lumière (capteur solaire)
III- Variation d'énergie interne et capacité thermique massique
Lorsque la température d'un corps solide ou liquide varie d'une valeur initiale Θi à une valeur finale
Θf, la quantité de chaleur, Q (ou énergie thermique) transférée, égale à la variation d'énergie interne
U est : Q
(J)
= DU
(J)
= m
(kg)
xc
(J.kg-1 .°C-1 )
(θf - θi)
(°C)

La capacité thermique massique, c dépend de la substance constituant le solide ou liquide, c'est la
quantité d'énergie nécessaire pour augmenter la température d'une masse d'un kilogramme d'un
°C (ou d'un kelvin).
La capacité thermique massique de l'eau est très importante : l'été l'eau des mers et des océans
emmagasine de grandes quantités d'énergie qu'elle restitue l'hiver et adoucit le climat des régions
côtières. C'est aussi pour cette raison que le chauffage central par radiateurs est souvent préféré
aux radiateurs électriques : les variations de température sont moins brutales, l'eau ayant une
grande inertie thermique.
Le béton, la brique pleine ou la pierre ont sensiblement la même capacité thermique massique :
en construction de bâtiments, les murs accumulateurs d'énergie doivent avoir des masses
importantes (béton pierre ou briques pleines) pour accumuler une grande quantité d'énergie.
1
/
2
100%