Cellules Natural Killer : une cible thérapeutique potentielle au cours

Mise au point
mt 2011 ; 17 (1) : 34-40
Cellules Natural Killer :
une cible thérapeutique
potentielle au cours des
maladies auto-immunes ?
Nicolas Schleinitz
Service de médecine interne, AP-HM Hôpital de la Conception, Université de la
Méditerranée, 147, boulevard Baille, 13385 Marseille Cedex 5, France
Les cellules Natural Killer (NK) ont une fonction, connue de longue date, dans les défenses
anti-infectieuses et antitumorales. Leur rôle anti tumoral est actuellement l’objet de travaux
de développement clinique dans le domaine thérapeutique. Plus récemment, leur rôle dans
les pathologies inflammatoires et auto-immunes a été évoqué sur des données expérimentales
chez l’animal et chez l’Homme. Des anomalies des cellules NK circulantes ont notamment
été décrites au cours du lupus érythémateux systémique. Des travaux futurs devront préci-
ser comment les cellules NK interviennent dans l’apparition, le maintien ou l’aggravation
des pathologies inflammatoires et/ou auto-immunes afin d’envisager une modulation de leur
fonction à visée thérapeutique.
Mots clés : cellules Natural Killer, pathologie inflammatoire, pathologie auto-immune, lupus
érythémateux systémique
Les cellules Natural Killer (NK)
sont un des acteurs majeurs de
la réponse immunitaire innée et leur
rôle a été démontré de longue date
dans les défenses anti infectieuses et
anti tumorales. Leur meilleure carac-
térisation et la meilleure connais-
sance des mécanismes de régula-
tion de leurs fonctions a permis
leur exploration dans les patholo-
gies auto-immunes. De nombreuses
modifications fonctionnelles ont été
rapportées et suggèrent que les cel-
lules NK ont soit un rôle promoteur
soit un rôle protecteur au cours des
différentes maladies auto-immunes.
L’objectif de cette revue est de rap-
peler les connaissances actuelles sur
la physiopathologie de ce compar-
timent cellulaire et les données des
études menées sur les cellules NK
au cours des maladies auto-immunes
chez l’Homme. Ces résultats per-
mettent de formuler des hypothèses
quant à l’implication des cellules NK
au cours de ces affections et laissent
envisager leur rôle en thérapeutique.
Les cellules Natural
Killer
Les cellules Natural Killer (NK)
sont des lymphocytes différenciés
à partir d’un précurseur commun
avec les lymphocytes T, dont ils
partagent certaines caractéristiques
phénotypiques. Ces cellules sont des
acteurs importants de la réponse
immunitaire innée. Leur appella-
tion de «tueuses »vient de leur
capacité, connue de longue date,
à détruire une cible cellulaire par
cytotoxicité directe, sans «immuni-
sation »préalable contrairement à
la cytotoxicité des lymphocytes T
ou à la cytotoxicité anticorps
dépendante (ADCC). En cytologie
rien ne les distingue des autres
lymphocytes cytotoxiques : il s’agit
de grands lymphocytes granuleux.
Les inclusions azurophiles cytoplas-
miques contiennent les molécules
granzyme et perforine, effecteurs
de la cytotoxicité cellulaire. Phé-
notypiquement les cellules NK se
doi:10.1684/met.2011.0311
mt
Tirés à part : N. Schleinitz
34
Pour citer cet article : Schleinitz N. Cellules Natural Killer : une cible thérapeutique potentielle au cours des maladies auto-immunes ? mt 2011 ; 17 (1) : 34-40
doi:10.1684/met.2011.0311
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

distinguent des lymphocytes T car ils n’expriment pas
le CD3/TCR (T-Cell receptor), mais les marqueurs CD16
(récepteur de faible affinité pour les IgG) et CD56 (iso-
forme de N-CAM) qui ne leur sont pas spécifiques. Les
cellules NK doivent être différenciées des lymphocytes
T exprimant des récepteurs NK et des cellules NKT qui
expriment le CD3 et un récepteur de l’antigène invariable
exprimant les chaine V␣24 et V11 du TCR (figure 1).
Une certaine confusion a pu exister dans la littérature du
fait de l’appellation et de certaines similitudes phénoty-
piques entre ces sous-populations lymphocytaires dont
les fonctions sont cependant très différentes. Un triple
marquage (CD3- CD16+ CD56 + ) permet d’évaluer quan-
titativement le compartiment NK du sang circulant. Le
niveau d’expression du CD56 permet de distinguer deux
sous-populations de cellules NK présentant des diffé-
rences fonctionnelles. La population CD56dim (expression
faible) est majoritaire et représente 90% des cellules NK
circulantes. Elle se caractérise par une forte cytotoxicité
naturelle, un faible pouvoir prolifératif en culture et une
faible production de cytokines. La population CD56bright
(forte expression) est minoritaire dans le sang (10%). Elle
est peu cytotoxique, a un fort pouvoir prolifératif en pré-
sence d’IL-2 et produit de l’IFN␥et du TNF␣[1]. Les
cellules NK sont une source cellulaire importante pour
la production d’IFN␥. Les cellules NK CD56bright sont
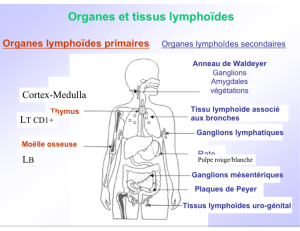
celles que l’on retrouve au niveau des organes lymphoïdes
secondaires [2] et au niveau de la muqueuse utérine
Lymphocytes NK CD3- CD56bright
Lymphocytes NK CD3- CD56dim
CD56
Lymphocytes T CD3+ CD56+ (NKT)
Lymphocytes T CD3+ CD56-
100
100
101
101
102
102
103
103
104
104
CD3
Figure 1. Individualisation des lymphocytes NK en cytométrie
de flux. Les cellules NK sont définies phénotypiquement par
l’expression de deux marqueurs non spécifiques, CD56 et CD16 et
l’absence d’expression du CD3. Le diagramme présente les résul-
tats d’une analyse des populations lymphocytaires d’un individu
sain par un double marquage par un anti-CD56 et anti-CD3. On
isole très bien les cellules NK qui sont CD56+ et CD3- et on diffé-
rencie bien les deux sous populations CD56bright et CD56dim.Ce
diagramme montre bien la présence d’une sous-population lympho-
cytaire T définie par l’expression du CD3 qui exprime également le
CD56. Les cellules dites NKT font partie de cette sous population.
pendant la gestation. Le compartiment NK du sang cir-
culant est bien caractérisé mais la répartition tissulaire des
cellules NK chez l’homme reste encore mal connue et
fait l’objet de travaux de recherche. Les cellules NK sont
par leurs caractéristiques et leurs propriétés fonctionnelles
impliquées dans la réponse immunitaire anti virale et anti
tumorale. De nombreux arguments suggèrent également
une implication dans les maladies autoimmunes et inflam-
matoires.
Fonctions des cellules NK
Les fonctions des cellules NK sont multiples : cyto-
toxicité naturelle, cytotoxicité dépendante des anticorps,
production de cytokines et interactions cellulaires notam-
ment avec les cellules dendritiques. Ainsi les cellules
NK sont à la fois un acteur des la réponse immunitaire
innée, un lien entre la réponse innée et adaptative par leur
interaction avec les cellules dendritiques et la production
précoce de cytokines et un «effecteur »de la réponse
immunitaire adaptative par le biais de l’ADCC.
Cytotoxicité naturelle
Les effecteurs de la cytotoxicité NK sont non spéci-
fiques. Cette cytotoxicité est liée soit à la dégranulation
des granules cytotoxiques contenant de la perforine et du
granzyme soit à l’induction de l’apoptose via l’expression
de FasL ou TRAIL [3]. Cette dégranulation peut-être ana-
lysée directement en cytométrie de flux par l’expression à
la membrane cellulaire du CD107a (figure 2) en présence
d’une cible cellulaire. Le déclenchement de cette cytotoxi-
cité cellulaire naturelle est induite par la reconnaissance
de ligands sur la cellule cible. Plusieurs récepteurs NK
activateurs sont impliqués dans cette reconnaissance. Les
NCR (Natural Cytotoxicity Receptors) NKp44, NKp46,
NKp30 et NKG2D [4]. NKG2D reconnaît des molécules
induites par le stress cellulaire (infection virale ou trans-
formation tumorale) : MICA, MICB et ULBPs [5]. Les
ligands des autres NCR, NKp44 et NKp46, sont actuel-
lement mal caractérisés. Certains travaux ont montré que
NKp46 et NKp44 reconnaissent l’hémagglutinine du virus
influenzae et des tests in vitro ont montré que des lignées
tumorales expriment des ligands pour ces récepteurs.
NKp30 intervient dans la coopération entre les cellules
NK et les cellules dendritiques. L’activation cellulaire
après engagement de ces différents récepteurs est liée à
leur association à des protéines transmembranaire. Ces
protéines KARAP/DAP-12, CD3et FcR␥possèdent des
motifs ITAM (Immunoreceptor Tyrosine-based Activation
Motif) permettant le recrutement, après activation, de tyro-
sines kinases dont syk. NKG2D quant à lui est associé à
DAP10, un adaptateur de signalisation dépourvu d’ITAM.
[12,17rmi]. Les cellules NK expriment également à leur
mt, vol. 17, n◦1, jan-fév-mars 2011 35
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Mise au point
A
-
Cellule CibleCellule NK
+
B
CIFNγ
IL-10, IL-5, IL13, IL
TNFα
GM-CSF
MIP1α, MIP1β, IL-8, RANTES
Figure 2. Fonction des cellules NK. A) La cytotoxicité naturelle
des cellules NK est sous le contrôle de récepteurs inhibiteurs
et activateurs. Les récepteurs inhibiteurs reconnaissent les molé-
cules du CMH de classe I. Les réceoteurs activateurs ou NCRs
reconnaissent des ligands induits par le stress cellulaire. Le déce-
lenchement de la cytotoxicité NK dépendra de la balance des
signaux inhibiteurs et activateurs. B) Les cellules NK peuvent ecxer-
cer la cytotoxicité par un mécanisme d’ADCC via l’expression du
CD16 qui est le récepteur de faible affinité pour le fragment Fc des
IgG. C : Les fonctions NK sont aussi liées à la production de cyto-
kines. Cette production de cytokines est importante dans le cadre
des défenses anti infectieuses et notamment antivirales (IFN␥). Les
cellules NK sont une source précoce de production de cytokines.
surface d’autres molécules d’activation: CD2, NKp80
et 2B4 (CD244) ; des molécules d’adhérence : LFA-1,
DNAM-1, CD62-L, Pen5/PSGL-1 et CD44; des récepteurs
aux cytokines : IL-1R, IL-2R␣␥, IL-12R, IL-15R, IL-18R
et IL-21R et des récepteurs pour certaines chimiokines :
CXCR3, CXCR1, CXCR4 et CCR7 [1].
Cytotoxicité dépendante des anticorps
Les cellules NK CD56dim expriment fortement le CD16
ou Fc␥RIIIa qui est le récepteur de faible affinité pour le
fragment Fc des IgG, responsable de l’ADCC. Ce récep-
teur permet l’acquisition d’un répertoire par la fixation des
IgG. L’activation des cellules NK via le CD16 induit la
dégranulation et la production d’IFN␥. L’importance de
l’ADCC sur le plan thérapeutique à été démontrée par
l’impact du polymorphisme 158VF [6] du Fc␥RIIIA, qui
augmente l’affinité pour les IgG, dans la réponse aux anti-
corps monoclonaux notamment en oncologie [7, 8]. Ces
travaux soulignent également l’importance des cellules
NK sur la réponse thérapeutique aux anticorps monoclo-
naux.
L’impact des immunoglobulines polyvalentes
humaines sur les cellules Natural Killer a été peu
étudié. Un travail a cependant montré qu’elles entrai-
naient une diminution d’expression du CD16 et une
modulation des fonctions cytotoxiques NK [9].
Interactions avec les cellules dendritiques (DCs)
L’interaction entre les cellules dendritiques et les cel-
lules NK peut avoir lieu dans les ganglions, où peuvent
migrer les cellules NK, mais également au niveau des sites
inflammatoires tissulaires. Cette interaction est complexe
[10]. Les cellules NK détruisent par cytotoxicité les cellules
dendritiques immatures. La reconnaissance des cellules
dendritiques immatures repose sur leur faible niveau
d’expression du CMH de classe I contrairement aux cel-
lules dendritiques matures qui l’expriment fortement. Les
cellules NK induisent également la maturation des DCs
et réciproquement les DCs induisent la prolifération des
NK [11]. Ainsi les cellules NK sont supposées exercer
un contrôle sur la maturation des cellules dendritiques et
donc l’initiation et l’orientation de la réponse immunitaire
adaptative. Il existe en fait un contrôle réciproque entre les
cellules NK et les cellules dendritiques. Ainsi les cellules
dendritiques via la production d’IL12 peuvent induire par
les cellules NK la production soit d’IFN␥, soit d’IL-10 qui
est une cytokine immunorégulatrice.
Contrôle et éducation des cellules NK
Contrôle de l’activation des cellules NK
La cytotoxicité naturelle (figure 3)est dépendante de
l’expression du CMH de classe I par les cellules tumo-
rales, c’est la théorie du «soi manquant »(missing self)
[12]. Les cellules NK lysent les cellules tumorales qui
n’expriment pas le CMH de classe I alors que les mêmes
lignées qui l’expriment sont résistantes. Cette théorie du
«soi manquant »s’explique par l’expression de récep-
teurs inhibiteurs par les cellules NK : récepteurs KIR-L
(Killer cell Immunoglobulin-like Receptor), CD94/NKG2
et ILT (CD85) (Immunoglobulin-Like Transcript) reconnais-
sant différentes molécules du CMH de classe I [13]. La
reconnaissance par ces récepteurs de molécules du CMH
de classe I sur une cible cellulaire permet d’inhiber la
cytotoxicité NK. Les cellules NK contrôlent ainsi la qua-
lité de l’expression du CMH de classe I par les cellules
de l’organisme. L’engagement de ces récepteurs permet,
par le recrutement de tyrosines phosphatases, de blo-
quer la transduction du signal activateur. Une affection
rare, dénommée «pseudo-Wegener », liée à un défaut
d’expression des molécules du CMH de classe I, illustre
ce fait puisque les lésions tissulaires sont en partie liées à
un défaut de contrôle par les CMH de classe I des cellules
NK autologues [14].
36 mt, vol. 17, n◦1, jan-fév-mars 2011
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Contrôle négatif En présence de K562 ADCC
CD107
IFNγ
100
100
101
101
102
102
103
103
104
104
4.97 0.32 10.5 8.34 13.4 9.53
100
100
101
101
102
102
103
103
104
104
100
100
101
101
102
102
103
103
104
104
76.4
91.2 70.1 74.753.47
Figure 3. Analyse par cytométrie de flux de l’activation des cellules NK. L’activation des cellules NK peut se mesurer par leur production
d’IFN␥et par la quantification de la cytotoxicité naturelle ou dépendante des anticorps (ADCC). On analyse en routine l’expression à
la surface des cellules NK du CD107a pour évaluer la dégranulation qui est l’étape indispensable à la cytotoxicité. On analyse dans un
même temps la production d’IFN␥. A : cellules NK en présence d’un milieu contrôle, il y a très peu de cellules NK exprimant le CD107a ou
produisant de l’IFN␥.B:Enprésence de cellules K562 (lignée tumorale sensible à la cytotoxicité naturelle NK) on note la dégranulation
(CD107a + ) et la production d’IFN␥par une partie des cellules NK.C:Onnote également une dégranulation et un production d’IFN␥dans
un test d’ADCC.
Ces récepteurs inhibiteurs possèdent une contrepartie
activatrice les KIRs dont la portion extracellulaire est d’une
grande homologie. La balance entre les signaux inhibi-
teurs principalement liés à la reconnaissance du CMH de
classe I sur la cible et les signaux activateurs NCR ou KIRs
va réguler les fonctions des cellules NK et notamment leurs
fonctions cytotoxiques.
Les gènes codant pour les récepteurs KIRs (activateurs
et inhibiteurs) et ILT sont localisé sur un même locus sur
le chromosome 19. Un polymorphisme génétique existe
quant au nombre de gènes présents dans le locus (il existe
surtout une variation dans le nombre de gènes KIR acti-
vateurs) et sur des variations de séquences allèliques pour
plusieurs de ces gènes. Cette variabilité génétique est à la
base des études d’associations avec certaines pathologies
auto-immunes ou inflammatoires.
Education des cellules NK
Cette découverte relativement récente ne fait pas réfé-
rence au même processus que celui, complexe, de la
maturation lymphocytaire B ou T. Ce terme d’éducation
fait référence au fait que les cellules NK seront capables
de cytotoxicité ou de production d’IFN␥lorsqu’elles ren-
contreront une cible que si au préalable les récepteurs
inhibiteurs reconnaissant le CMH de classe I (KIR-L) ont
été en contact avec leur ligand. Ce n’est donc qu’en cas
de reconnaissance d’un ligand inhibiteur qu’une activa-
tion de la cellule NK pourra survenir dans un deuxième
temps lors de la reconnaissance d’un ligand activateur.
Les cellules NK en pathologie
auto-immune chez l’homme
Basé sur les connaissances fondamentales acquises on
peut proposer plusieurs modèles d’implication théorique
des cellules NK dans la physiopathologie des maladies
auto-immunes (figure 4) :
1) autoréactivité NK naturelle par défaut ou anoma-
lie d’expression du CMH de classe I (défaut de signal
inhibiteur) ;
2) prédisposition génétique aux maladies auto-
immunes liée aux haplotypes ou gènes KIR ;
3) orientation de la réponse immunitaire adaptative
par le biais, soit du contrôle de la maturation des cellules
dendritiques, soit par un rôle de cellule présentatrice de
l’antigène soit par la production de cytokines ;
4) une interaction avec les cellules T régulatrices ;
5) un rôle de cellule effectrice notamment par
l’ADCC.
Les données en pathologie auto-immune
chez l’homme
Des anomalies du compartiment NK circulant ont
été rapportées par plusieurs auteurs, au cours du lupus
érythémateux disséminé (LED), du syndrome de Gougerot-
Sjögren, de la sclérose en plaque, de la polyarthrite
rhumatoïde, de la thyroïdite auto-immune et du diabète
de type I. Jusqu’à présent il a été mis en évidence, par
plusieurs équipes et de fac¸on répétitive, une diminu-
tion significative du nombre de cellules NK dans le sang
mt, vol. 17, n◦1, jan-fév-mars 2011 37
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Mise au point
A
NK
B
Contrôle de la réponse auto-immune
-T
DCs
-
IL-10
Autoantigène
B
NK BNK
Lésions tissulaires
Rôle promoteur de la réponse auto-immune
Autoantigène +
T
DCs
ADCC
+
Macrophage
Figure 4. Rôle potentiel des cellules NK dans la physiopathologie des maladies auto-immunes. A) Les NK peuvent avoir un rôle protecteur
vis-à-vis des maladies auto-immunes : 1/ Destruction des cellules dendritiques immatures qui pourraient potentiellement présenter des auto
antigènes ; 2/ Contrôle négatif sur la réponse auto réactive lymphocytaire T et B par la production e cytokines immunorégulatrices. Un défaut
de fonctions NK pourrait ainsi favoriser les maladies auto-immunes. B) Les NK peuvent avoir un rôle promoteur dans les maladies auto-
immunes : 1/ Maturation des cellules dendritiques présentant des auto antigènes 2/ Activation des macrophages au niveau des tissulaire
entrainant les lésions tissulaires 3/ Rôle effecteur par les biais de l’ADCC et la reconnaissance de cibles recouvertes d’autoanticorps.
circulant, associée à une baisse des fonctions cytotoxiques
vis à vis de cibles cellulaires naturellement sensibles à la
lyse par les cellules NK. Ces anomalies pourraient être
corrélées à l’activité de la maladie lupique [15-17]. De
telles anomalies ont également été rapportées au cours
du syndrome d’activation macrophagique et de l’arthrite
juvénile [18]. Il n’est pas clair aujourd’hui si ces anoma-
lies sont la conséquence de la pathologie, du traitement
immunosuppresseur, ou si elles participent aux désordres
immunitaires sous-jacents à celle-ci. Dans le pemphi-
gus contrairement aux données observées dans les autres
maladies auto-immunes il a été rapporté une augmen-
tation du compartiment NK circulant [19]. L’étude de
l’implication des cellules NK, ou plus justement des récep-
teurs KIR (nous avons vu que ces récepteurs pouvaient être
exprimés par des sous-populations lymphocytaires T) dans
les pathologies auto-immunes a également été abordée
par une approche génétique analysant l’association entre
les génotypes ou haplotypes KIRs, du CMH de classe I et
les pathologies. Il a ainsi été retrouvé une association entre
certains génotypes KIR/CMH et la survenue d’un rhuma-
tisme psoriasique [20, 21] ou encore d’une sclérodermie
systémique [22]. Les pathologies associées à un CMH de
classe I particulier sont un champ d’exploration intéressant
dans ce contexte.
L’exemple du lupus érythémateux disséminé
Les lupus érythémateux disséminé (LED) est une
pathologie associée à une réponse auto-immune non spé-
cifique d’organe. La physiopathologie est sous tendue par
un excès de corps apoptotiques induisant l’apparition
d’autoanticorps dirigés vis-à-vis d’antigènes nucléaires.
Comme pour les autres maladies auto-immunes la réponse
immunitaire adaptative est donc primordiale dans la phy-
siopathologie. L’implication des cellules NK au cours
du LED est fondée sur les mêmes bases hypothétiques
que celles avancées précédemment pour les maladies
auto-immunes. Par ailleurs le rôle joué par les facteurs
environnementaux, et notamment les infections virales,
38 mt, vol. 17, n◦1, jan-fév-mars 2011
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.
 6
6
 7
7
1
/
7
100%