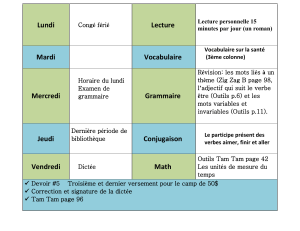
Traitement médical du carcinome in situ

COLLÈGE NATIONAL
DES GYNÉCOLOGUES ET OBSTÉTRICIENS FRANÇAIS
Président : Professeur F. Puech
EEXXTTRRAAIITT ddeess
MMiisseess àà jjoouurr
eenn ggyynnééccoollooggiiee mmééddiiccaallee
VVoolluummee 22001100
PPuubblliiéé llee 1100 ddéécceemmbbrree 22001100
——
TRENTE-QUATRIÈMES JOURNÉES NATIONALES
Paris, 2010

365
Résumé
Le cancer in situ (CIS) comprend les cancers canalaires (CCIS) et lobulaires in
situ (CLIS). L’objectif d’un traitement médical du CIS pourrait être soit de réduire le
risque de récidive ipsi ou controlatérale (visée adjuvante), soit de prévenir l’apparition
d’un CIS (visée préventive).
Nous disposons de très peu d’études concernant l’efficacité du tamoxifène (Tam) à
visée adjuvante, et celles-ci sont discordantes. Les dernières recommandations de bonnes
pratiques de l’INCa concluent qu’il n’y a pas d’indication à une hormonothérapie
adjuvante dans le CCIS en dehors des essais randomisées prospectifs.
À visée préventive, nous disposons de plusieurs essais testant l’efficacité du Tam et
du raloxifène (Ral) chez les femmes à risque de cancer du sein. Les caractéristiques et les
résultats de ces études sont présentés dans ce travail. Globalement, le Tam et le Ral
réduisent de façon équivalente le risque de cancer du sein chez des femmes à haut risque,
et le Tam est plus efficace sur la réduction des cancers in situ, mais il faut mettre en
balance leurs avantages et leurs inconvénients respectifs.
* Institut Curie - Pôle de sénologie - 26 rue d’Ulm - 75248 Paris cedex 05
Correspondance : [email protected]
Traitement médical du carcinome
in situ
P. THIS *
(Paris)

Enfin, plusieurs essais testant l’efficacité préventive des inhibiteurs de l’aromatase
sont actuellement en cours. En France, actuellement aucun de ces composés n’a
d’autorisation de mise sur le marché en prévention du cancer du sein.
Mots clés : tamoxifène, raloxifène, carcinome in situ, prévention
Déclaration publique d’intérêt
L’auteur déclare ne pas avoir d’intérêt direct ou indirect (financier
ou en nature) avec un organisme privé, industriel ou commercial, en
relation avec le sujet présenté.
Parmi les carcinomes in situ (CIS), on distingue les carcinomes
canalaires (CCIS) et les carcinomes lobulaires in situ (CLIS). Les CCIS
représentent 85 à 90 % des CIS, et 15 à 20 % des cancers du sein, soit
en France 7 000 à 8 000 nouveaux cas par an. Leur incidence est en
augmentation du fait de la généralisation du dépistage. Leur pronostic
est globalement favorable (survie à 10 ans supérieure à 95 %) mais le
taux de récidive invasive peut atteindre 13 % selon le type de
traitement. Les CLIS représentent 10 à 15 % des CIS soit 0,5 à 3,8 %
de l’ensemble des cancers [1]. Comme il s’agit de lésions assez rares,
leur prise en charge reste actuellement peu standardisée.
La Société de sénologie et de pathologie mammaire et l’INCa ont
récemment actualisé les recommandations de prise en charge des CIS
[1]. Le traitement du CCIS repose aujourd’hui sur la chirurgie et la
radiothérapie ; celui du CLIS associe diversement la surveillance, la
chirurgie et la radiothérapie, la stratégie thérapeutique étant orientée
selon la classification LIN (Lobular Intra epithelial Neoplasia) divisée
en 3 catégories (LIN 1 à 3).
L’objectif de cette présentation est de déterminer s’il existe ou non
actuellement une place pour le traitement médical du CIS. L’objectif
pourrait être soit de réduire le risque de récidive après traitement d’un
CIS, soit de réduire la survenue d’un CIS (de type canalaire ou
lobulaire).
366
THIS

1. PROFIL DE RISQUE DES PATIENTES
Les données actuelles sur la chimioprévention reposent sur des
essais thérapeutiques dont les critères d’inclusion sont en général
fondés sur la détermination, par des moyens variés, du profil de risque
de cancer du sein des femmes. Les principaux facteurs de risques
(FDR) de cancer du sein sont récapitulés dans le tableau 1. Globale-
ment, outre le fait d’avancer en âge, on distingue les antécédents
familiaux, les FDR histologiques, et les FDR hormonaux. Plus
récemment, d’autres facteurs ont été individualisés tels qu’une densité
mammaire élevée à la mammographie, une densité minérale osseuse
élevée, des taux sanguins d’œstradiol ou de testostérone élevés [2], ou
des antécédents d’exposition aux radiations [3]. Une densité mammaire
élevée, notamment, s’avère un FDR particulièrement intéressant : une
densité cotée à 4 selon le système BI RAD multiplie par environ 4 le
risque de cancer du sein par rapport à une densité cotée 1 [2].
367
TRAITEMENT MÉDICAL DU CARCINOME IN SITU
Type Multiplication du risque relatif
Familiaux. Antécédents de cancer du sein
Mère 1,8
Sœur 2,5
Mère + sœur 5,6
Histologiques (biopsie mammaire préalable)
Hyperplasie simple 1,3
Hyperplasie atypique 4,3
Carcinome lobulaire in situ (CLIS) 8 - 10
Gynécologiques
Puberté précoce (< 12 ans) 1,2 - 1,5
Ménopause tardive (> 55 ans) 1,5 - 2
1re grossesse tardive (> 35 ans) 1,3 - 2,2
Facteurs « divers »
Densité minérale osseuse élevée 2
Densité mammaire élevée 2-3
Exposition aux radiations ionisantes
2-3
avant 30 ans
(ex. irradiation pour maladie de Hodgkin)
Tableau 1 - Facteurs de risque de cancers du sein [3]
En cas d’antécédents familiaux, les risques augmentent avec le nombre d’apparentées atteintes et la précocité des cancers du sein.
En cas de mutation génétique BRCA1/2, les risques relatifs varient selon la tranche d’âge des femmes, et sont très élevés, leur
conférant des risques absolus de cancer du sein de l’ordre de 45 % à 65 % à l’âge de 70 ans.
En cas de carcinome lobulaire in situ, les sur-risques concernent les 15 années suivant l’intervention.

Actuellement, la détermination du risque absolu de cancer du sein
sur une période donnée peut être effectuée à l’aide de divers modèles
[2]. Ceux qui sont fondés sur les caractéristiques démographiques et
l’histoire médicale, s’ils sont performants à l’échelon d’une population,
ont en général une valeur discriminante modeste à l’échelon individuel
[4]. L’un des modèles les plus utilisés, le modèle de Gail [5], évalue le
risque de cancer du sein à partir de l’âge, de l’origine ethnique, des
antécédents familiaux de premier degré de cancer du sein, de l’âge aux
premières règles, de l’âge à la première grossesse menée à terme,
d’antécédent de biopsie mammaire ou d’hyperplasie atypique.
Globalement, pour Cutuli et al. [3], on peut individualiser trois
grandes catégories de niveau de risque :
— risque moyen (c’est-à-dire risque relatif < 1,5) : risque absolu de
cancer du sein de moins de 1,7 % à 5 ans selon le modèle de
Gail, ou biopsie mammaire montrant une hyperplasie épithéliale
simple ;
— risque élevé (risque relatif entre 1,5 et 5) : risque selon le modèle
de Gail supérieur à 1,7 %, biopsie mammaire retrouvant une
hyperplasie canalaire ou lobulaire atypique (HCA/HLA), ou
deux antécédents familiaux ou plus de cancer du sein avant la
ménopause ou prise de traitement hormonal de la ménopause
(estrogène + progestérone) pendant une durée supérieure à 10
ans ;
— risque très élevé (RR > 5) : antécédents personnels de cancer du
sein infiltrant ou de CIS (CCIS ou CLIS), ou biopsie mammaire
avec HCA/HLA et un antécédent familial de cancer du sein ou
mutation du gène BRCA1/2 ou irradiation thoracique avant l’âge
de 20 ans (maladie de Hodgkin).
Ainsi, un antécédent personnel de CIS place donc ipso facto une
femme dans une catégorie « à haut risque », justifiant la question posée
d’un éventuel traitement médical préventif des récidives sur le mode
infiltrant.
2. TRAITEMENT MÉDICAL DU CIS
D’un point de vue thérapeutique, nous disposons de peu de
données depuis celles de l’essai du NSABP B 24 actualisées en 2001
[6, 7] sur l’efficacité du tamoxifène (Tam) en prévention du risque de
récidive après CCIS : en effet, cet essai portant sur 1 804 patientes
368
THIS
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%