Le bilan préopératoire des cancers bronchiques

extension épidémique du tabagisme survenue au
cours de la seconde moitié du XXesiècle est à
l’origine d’une augmentation massive des mala-
dies en rapport avec le tabac (1). Aujourd’hui, un fumeur sur
deux décédera d’une maladie induite par la fumée de cigarette
(2). Le cancer bronchique est l’une des principales affections
mortelles induites par le tabac. La consommation de tabac est à
l’origine de 85 à 90 % des cas de cancer bronchique. Le cancer
bronchique est une maladie insidieuse. Lors de l’apparition des
symptômes, la maladie est souvent trop avancée pour pouvoir
prétendre à un traitement curatif. Au moment du diagnostic,
seuls 15 à 25 % des malades sont susceptibles de bénéficier
d’un traitement chirurgical, et celui-ci reste, malgré les progrès
de la radiothérapie et de la chimiothérapie, le seul traitement
curatif. Le bilan préopératoire des malades atteints d’un cancer
bronchique a un triple objectif : affirmer le diagnostic histolo-
gique, évaluer l’extension de la tumeur et apprécier les
réserves cardiorespiratoires du malade (figure 1). La nature
exacte de la tumeur est apportée par la cytologie ou l’histolo-
gie obtenue par analyse des crachats, prélèvements perendo-
scopiques, ponction transthoracique ou par biopsie chirurgi-
cale. L’extension de la maladie est évaluée grâce aux examens
radiologiques et, en particulier, la tomodensitométrie. La
nature histologique de la tumeur et son extension déterminent
le traitement. À de rares exceptions près, les cancers à petites
cellules relèvent d’un traitement médical (chimiothérapie ±
radiothérapie externe). Le traitement des cancers bronchiques
non à petites cellules est basé sur la classification en stades
mise à jour en 1997. Jusqu’au stade IIB, la chirurgie est le trai-
tement de référence. Au stade IIIA, une chirurgie peut être
proposée après une chimiothérapie néoadjuvante efficace. Aux
stades IIIB et IV, la tumeur est inopérable. La meilleure straté-
gie thérapeutique des stades III reste à définir. Les études
actuellement en cours sont susceptibles de modifier notre
approche thérapeutique des stades III.
Lorsque le bilan d’extension l’autorise, un traitement chirurgi-
cal à visée curative est proposé (au minimum une lobectomie).
Ce traitement va priver le malade d’une partie non négligeable
de son parenchyme pulmonaire. L’amputation fonctionnelle
est importante à prendre en compte chez des malades présen-
tant souvent des comorbidités en rapport avec leur intoxication
tabagique et qui aggravent le risque opératoire. Il est donc
indispensable d’évaluer en préopératoire les fonctions vitales
des malades.
Cette revue générale a pour objectif de détailler les différents
temps de ce bilan fonctionnel.
PARAMÈTRES FONCTIONNELS D’OPÉRABILITÉ
Le bilan doit être réalisé lorsque le malade est au maximum de
ses possibilités. L’évaluation de la fonction respiratoire doit se
faire après la mise en place d’un traitement optimal, en parti-
culier à visée anti-obstructive. Ce traitement est généralement
basé sur l’association d’un corticoïde per os (40 mg de predni-
sone par jour, 3 à 4 semaines) et de bronchodilatateurs inhalés.
Beaucoup de malades souffrant d’une bronchopneumopathie
chronique obstructive (BPCO), l’association de b2-mimétiques
et d’ipratropium est souvent bénéfique. Le traitement inhalé
peut faire appel à des sprays doseurs ou à des aérosols. Une
kinésithérapie respiratoire, associée si possible à un réentraîne-
ment à l’effort, doit également être initiée. Le sevrage taba-
gique doit être obtenu. L’évaluation régulière de la fonction
respiratoire permet d’apprécier les capacités maximales du
MISE AU POINT
209
La Lettre du Pneumologue - Vol. II - n° 6 - décembre 1999
Le bilan préopératoire des cancers bronchiques
●
Ch.T. Bolliger*
* Faculté de médecine, université de Stellenbosch, Cape Town, Afrique
du Sud.
L’
15-25 % opérables
Diagnostic
• Carcinome bronchique
non à petites cellules
• Carcinome bronchique
à petites cellules
Stade
• I-IV TNM
• Limité/diffus
Fonction
• VEMS
• DLco
• VO2 max
•
Figure 1. Les cercles représentent les trois entités qui déterminent les
modalités de prise en charge des malades atteints d’un cancer du pou-
mon.

malade. Le délai avant l’intervention ne peut excéder un à
deux mois. Le tableau I rappelle les paramètres fonctionnels à
étudier pour décider de l’opérabilité.
Âge
Un âge avancé, c’est-à-dire au-delà de 70 ans, s’accompagne
d’une augmentation de la fréquence des complications après
une chirurgie de résection pulmonaire (3-5). L’accroissement
du risque opératoire semble être en rapport avec l’augmenta-
tion des comorbidités des malades de plus de 70 ans. Les
malades de plus de 65 ans avec une bonne aptitude à l’effort
ne présentent pas d’augmentation du risque postopératoire (6).
Aussi l’âge n’est-il pas un critère d’inopérabilité en soi.
Risque cardiaque
Lors de la prise en charge d’un malade en vue d’une chirurgie
de résection pulmonaire, il faut garder à l’esprit l’importance
des complications extrarespiratoires et en particulier cardio-
vasculaires. La préexistence d’une anomalie ECG est associée
à une fréquence accrue de complications cardiaques (insuffi-
sance cardiaque, arythmie, infarctus du myocarde) en per- et
postopératoire. Un antécédent d’infarctus du myocarde dans
les six mois précédents (7), et plus particulièrement dans les
trois derniers mois (8), est associé à un risque opératoire
majeur. Si nécessaire, un pontage coronarien doit être réalisé
au préalable.
La survenue de troubles du rythme en postopératoire est cou-
rante, mais il n’existe aucun consensus en faveur de la pres-
cription d’un traitement antiarythmique préventif.
Hémodynamique pulmonaire
La réduction du lit vasculaire pulmonaire après la chirurgie
peut entraîner une hypertension artérielle pulmonaire à l’ori-
gine d’une insuffisance cardiaque droite chez les malades
BPCO. Les recherches en vue de définir une pression artérielle
pulmonaire (PAP) maximale au-delà de laquelle il faudrait
renoncer à la chirurgie ont échoué. L’évaluation des PAP en
préopératoire ne peut être recommandée.
Spirométrie
Parmi l’ensemble des paramètres spirométriques testés, seul le
VEMS a fait la preuve de son utilité. Initialement, le VEMS de
base devait être supérieur à 2 l en vue d’une pneumonectomie
(9) et supérieure à 1,5 l en vue d’une lobectomie (10). Ces
valeurs n’ont jamais fait l’objet d’un consensus dans la mesure
où elles ne prennent pas en compte le sexe, l’âge, le poids, la
taille et la valeur fonctionnelle de la partie du poumon devant
être réséquée. L’intérêt s’est donc porté sur la fonction respira-
toire résiduelle. Les techniques d’évaluation de cette fonction
respiratoire résiduelle seront discutées dans le chapitre “Ana-
lyse sectorielle de la fonction respiratoire”. Ces techniques
concernent l’évaluation du VEMS (VEMS ppo), de la capacité
de diffusion (DLCO ppo) et de la consommation maximale
d’oxygène à l’effort (V
.O2max ppo) postopératoires.
Capacité de diffusion
La capacité de diffusion au monoxyde de carbone par la tech-
nique en apnée a été utilisée dès 1963 (11). Une valeur infé-
rieure à 50 % était considérée comme à haut risque. Ce seuil a
ensuite été ramené à 60 % (12). Les complications respira-
toires sont plus fréquentes en cas de DLCO basse (13). De la
même façon que pour le VEMS, la DLCO ppo permettrait de
prédire les complications postopératoires (14). Ce concept sera
discuté dans le chapitre “Analyse sectorielle de la fonction res-
piratoire”.
Mesure des gaz du sang
L’analyse des gaz du sang fait partie intégrante du bilan fonc-
tionnel préopératoire. La valeur prédictive de la PaO2est dou-
teuse. Il n’existe aucune valeur seuil permettant de prédire un
risque opératoire inacceptable. En revanche, l’intérêt de la
mesure de la PaCO2est évident. Une PaCO2supérieure à
45 mmHg est un facteur de risque important (15, 16). La
mesure de la PaCO2ne peut cependant permettre à elle seule
de récuser un geste chirurgical.
Étendue de la résection
L’évaluation de l’importance de la résection pouvant être réali-
sée sans risque est indispensable avant le geste opératoire. Le
développement des techniques d’évaluation sectorielle permet
d’évaluer la valeur fonctionnelle de la partie du poumon devant
être réséquée et de prédire la fonction respiratoire résiduelle.
Il existe une relation étroite entre l’importance du sacrifice
pulmonaire et la morbi-mortalité postopératoire.
Les résections atypiques ont le risque le plus faible, et les
pneumonectomies le risque le plus élevé (17). Les standards
internationaux permettent de considérer qu’une mortalité infé-
rieure à 5 % dans les 30 jours postopératoires est un bon résul-
tat et que, si elle est inférieure à 2 %, le résultat est excellent,
pourvu que les malades à haut risque ne soient pas exclus du
traitement chirurgical. Le risque de décès en cas de pneumo-
nectomie est doublé par rapport à la lobectomie. L’essentiel de
ces données proviennent de séries opératoires par thoracotomie
classique. Les nouvelles techniques faisant appel à une mini-
thoracotomie ou à une chirurgie video-assistée (CVA) permet-
traient de réduire le risque opératoire.
Analyse sectorielle de la fonction respiratoire
Les malades ayant une fonction respiratoire normale tolèrent
sans difficulté une pneumonectomie. Par contre, pour les
malades ayant une fonction respiratoire anormale, une évalua-
MISE AU POINT
210
La Lettre du Pneumologue - Vol. II - n° 6 - décembre 1999
Âge
Fonction cardiaque
Hémodynamique pulmonaire
Spirométrie
Capacité de diffusion
Gaz du sang
Étendue de la résection
Études sectorielles
Tests d’effort
Tableau I. Paramètres à évaluer en vue d’une chirurgie de résection
pulmonaire.

tion préopératoire de la fonction résiduelle est indispensable
afin de mesurer les risques du geste opératoire. Généralement,
l’indicateur utilisé est le VEMS ppo, obtenu à partir d’une
scintigraphie de perfusion au technetium 99. La formule per-
mettant de prédire le VEMS ppo est : VEMS ppo = VEMS
préopératoire x (1 – la contribution fonctionnelle du paren-
chyme réséqué).
À ce jour, il n’existe aucun consensus sur la valeur inférieure
seuil du VEMS permettant de prévoir l’absence de complica-
tion postopératoire. Les études les plus récentes suggèrent
l’utilisation du VEMS ppo en pourcentage de la valeur nor-
male prédite. En dessous de 40 % de la normale, il existe une
augmentation du risque opératoire, et, en dessous de 35 %, le
risque que le malade présente une complication est majeur (18,
19). L’utilisation de la valeur absolue est à éviter car elle ne
tient pas compte des paramètres individuels. La même formule
que pour le VEMS ppo peut être étendue à la DLCO ppo (14)
et V
.O2max à la ppo (19). Le seuil de 40 % des valeurs prédites
permet également de prédire un risque opératoire majeur.
Faute de scintigraphie, la valeur résiduelle fonctionnelle peut
être estimée, pour le VEMS, par la formule : VEMS ppo =
VEMS x y/19, y étant le nombre de segments destinés à être
réséqués et 19 le nombre total de segments pulmonaires (10).
Cette formule permet de se dispenser d’une scintigraphie de
perfusion, mais elle ne prend pas en compte la valeur fonction-
nelle réelle du parenchyme pulmonaire devant être réséqué. Le
risque est donc de sous-estimer la fonction respiratoire rési-
duelle et de récuser des malades qui auraient pu bénéficier
d’un traitement curatif. Cet aspect a été pris en compte par une
autre formule (20), qui permet une estimation anatomique du
VEMS ppo avec une distinction entre sous-segments obstruc-
tifs et normaux. Cette formule est : VEMS ppo = [1 – (b –
n)/(42 – n)] x préop.VEMS, n et b étant respectivement le
nombre de sous-segments occlus, le nombre total de sous-seg-
ments devant être réséqués, et 42 le nombre total de sous-seg-
ments du poumon. Cette formule permet vraisemblablement
une bonne évaluation de la fonction résiduelle sous réserve que
le scanner thoracique ne montre pas d’hétérogénéité impor-
tante du parenchyme pulmonaire. L’analyse quantitative du
parenchyme pulmonaire par le scanner semble être une
approche prometteuse, en cours d’évaluation.
Épreuve d’exercice musculaire
L’ensemble des paramètres analysés jusque-là ne prend en
compte que certains aspects de la fonction résiduelle. Si l’on
souhaite prendre en compte l’ensemble des paramètres fonc-
tionnels, l’épreuve d’exercice musculaire semble constituer un
bon indicateur. Elle reflète l’aptitude physique d’un malade, ce
qui équivaut à évaluer ses réserves cardiorespiratoires. À
l’effort, la V
.O2, la ..
V
.CO2et le rendement cardiaque augmentent.
La puissance maximale que le malade est capable d’atteindre
reflète le fonctionnement du poumon, du cœur et du réseau
vasculaire. Dans une certaine mesure, l’intervention chirurgi-
cale reproduit le stress induit par un effort.
Habituellement, trois types de test sont réalisés : effort de la
vie courante, épreuve submaximale et épreuve maximale ou
limitée par des symptômes. L’essentiel de la littérature porte
sur les épreuves maximales, qui sont plus faciles à standardi-
ser. Le type même de l’effort de la vie courante qui peut être
utilisé est le nombre maximal d’étages que le malade est
capable de gravir. Pour envisager une lobectomie ou une pneu-
monectomie, il faut qu’il puisse gravir 3 ou 5 étages respecti-
vement (21). Aucune prédiction ne peut être tirée des tests de
marche de 6 ou 12 minutes. Les tests portant sur les efforts de
la vie quotidienne sont difficiles à standardiser et sollicitent de
façon insuffisante l’appareil cardiovasculaire. En l’absence
d’une unité d’exploration fonctionnelle permettant la réalisa-
tion d’une épreuve d’exercice musculaire, ces tests sont proba-
blement suffisants pourvu que le malade ne souffre pas d’une
cardiopathie ischémique. Le rationnel pour réaliser des
épreuves d’exercice musculaire submaximales est qu’il s’agit
de patients âgés souffrant de BPCO et souvent peu motivés.
Bien que moins épuisants, les protocoles de réalisation des
tests submaximaux semblent, d’après la littérature disponible,
invasifs et désagréables pour les malades. La tendance actuelle
s’oriente vers des tests d’effort moins invasifs, mais condui-
sant à un effort maximal.
Les épreuves maximales ou limitées par les symptômes ont
l’avantage d’être reproductibles, susceptibles de détecter une
coronaropathie grâce au monitoring ECG et de courte durée.
Lorsque le protocole d’incrémentation de la charge est indivi-
dualisé, le test ne dure pas plus de 15 à 20 minutes, y compris
la période de récupération. La bicyclette comme le tapis peu-
vent être choisis en toute sécurité. La tendance actuelle est
d’accorder surtout de l’importance à la V
.O2max, qui est plus
reproductible que la durée de l’épreuve. En l’absence du maté-
riel nécessaire à la mesure de la V
.O2, la V
.O2max peut être esti-
mée à partir de la puissance en watts atteinte.
Les données de la littérature indiquent que, pour une V
.O2max
inférieure à 10 ml/kg/mn (22) ou à 40 % de la valeur théo-
rique, le risque opératoire est considéré comme majeur et le
geste opératoire contre-indiqué. Pour une V
.O2max supérieure à
20 ml/kg/mn ou à 75 % de la valeur théorique (23), une pneu-
monectomie peut être envisagée en toute sécurité.
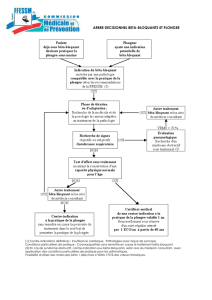
ALGORITHME POUR L’ÉVALUATION FONCTIONNELLE
DES MALADES DEVANT BÉNÉFICIER D’UNE CHIRURGIE
DE RÉSECTION PULMONAIRE
Malgré l’enthousiasme suscité par les évaluations sectorielles
et les épreuves d’effort, la plupart des malades peuvent bénéfi-
cier d’une résection allant jusqu’à la pneumonectomie sans
qu’il soit nécessaire de réaliser des tests fonctionnels com-
plexes. De plus, ces tests coûteux ne sont pas toujours dispo-
nibles. Un algorithme est donc indispensable pour rationaliser
la prescription de ces épreuves fonctionnelles. Une approche
moderne doit inclure les épreuves fonctionnelles respiratoires,
l’évaluation de la fonction respiratoire postopératoire prédite et
les tests d’effort.
L’analyse de la littérature récente et notre propre expérience
nous ont permis de construire un algorithme (figure 2). Grâce
à cet algorithme, nos taux de complications et de mortalité sont
respectivement de 15 % et 1,5 % (24).
211
La Lettre du Pneumologue - Vol. II - n° 6 - décembre 1999

Les malades sans antécédents cardiaques (ECG normal) et dont
le VEMS et la DLCO sont supérieurs à 80 % de la normale peu-
vent bénéficier d’une chirurgie de résection allant jusqu’à la
pneumonectomie sans exploration supplémentaire. Ce seuil de
80 % a été choisi parce que la fonction respiratoire résiduelle est
normalement supérieure à 40 %, même après pneumonectomie,
dans la mesure où le poumon malade contribue rarement à plus
de 50 % de la fonction respiratoire globale. Les malades ayant
des antécédents de maladie cardiaque doivent bénéficier d’une
évaluation cardiovasculaire soigneuse et, si besoin est, d’une
angioplastie ou d’un pontage coronaire. Seuls les patients ayant
une fonction cardiaque permettant la réalisation d’une interven-
tion bénéficieront des explorations de la fonction respiratoire. Si
le VEMS et la DLCO sont inférieurs à 80 % de la normale, une
épreuve d’effort sera réalisée pour déterminer la V
.O2max. Rare-
ment, l’épreuve révélera une atteinte coronarienne passée inaper-
çue et nécessitant une évaluation cardiaque plus poussée (ligne
discontinue sur l’algorithme). Si la V
.O2max est supérieure à
75 % ou à 20 ml/kg/mn, les malades pourront bénéficier d’une
chirurgie allant jusqu’à la pneumonectomie. Si la V
.O2max est
inférieure à 40 % ou à 10 ml/kg/mn, le malade est inopérable.
Entre ces deux seuils, les malades devront bénéficier d’une éva-
luation sectorielle à partir d’une scintigraphie de perfusion. Le
VEMS ppo et la DLCO ppo seront analysés en premier. Si ces
paramètres sont inférieurs à 40 %, les malades seront considérés
comme inopérables. S’ils sont supérieurs à 40 %, la V
.O2max ppo
deviendra le critère d’opérabilité. Si elle est inférieure à
35 % ou à 10 ml/kg/mn, le malade sera inopérable. Si la valeur
prédite est supérieure à 35 % ou à 10 ml/kg/mn, alors la résec-
tion prévue pourra être réalisée. Cet algorithme inclut les para-
mètres fonctionnels d’opérabilité et leurs seuils respectifs issus
de la littérature.
L’AVENIR
Actuellement, la technique chirurgicale recommandée est une
thoracotomie associée à une exploration minutieuse de
l’ensemble des aires ganglionnaires. Bien qu’une lobectomie
ou une pneumonectomie (25) soient techniquement réalisables
par chirurgie vidéo-assistée, il semble nécessaire de confirmer
son équivalence en termes de contrôle de la maladie.
La chirurgie de réduction de l’emphysème se développe actuel-
lement (26). Ces malades sont théoriquement inopérables si
l’on se réfère aux critères fonctionnels et d’effort, y compris
notre algorithme. Certains malades inopérables pourraient
bénéficier de la combinaison d’une chirurgie de réduction de
l’emphysème et d’une chirurgie carcinologique. Plusieurs
auteurs ont rapporté la faisabilité de l’association chirurgie de
réduction de l’emphysème et résection simultanée de nodules
pulmonaires situés dans les zones réséquées ou en dehors. Cer-
tains de ces nodules se sont avérés être des cancers bron-
chiques de stade I. Le geste a consisté parfois en une résection
atypique. Ce nouveau concept pourrait permettre de repousser
les limites de l’opérabilité. Il faut tout de même souligner que,
dans la plupart des cas (27, 28), ces malades étaient program-
més pour bénéficier d’une chirurgie de réduction de l’emphy-
sème et que le cancer a été découvert fortuitement sur le scan-
ner préopératoire. Les malades présentant un cancer
bronchique et dont le bilan révèle une fonction respiratoire
insuffisante pour envisager le geste chirurgical ont probable-
ment une maladie plus avancée. Les possibilités opératoires
chez ces malades sont vraisemblablement plus limitées. Le
suivi à long terme devrait permettre de s’assurer si une chirur-
gie non carcinologique peut être recommandée chez de tels
malades. L’allongement de la survie chez ces malades fonc-
tionnellement inopérables est probablement supérieur avec la
chirurgie qu’avec la radiothérapie, la chimiothérapie ou les
soins de confort.
L’association d’une chirurgie minimaliste et d’une chirurgie de
réduction de l’emphysème devrait permettre de repousser les
limites de l’opérabilité. La réponse à cette question nécessite la
réalisation d’études prospectives randomisées. En attendant, il
est clairement recommandé de suivre des algorithmes décision-
nels tels que celui que nous proposons. ■
MISE AU POINT
212
La Lettre du Pneumologue - Vol. II - n° 6 - décembre 1999
ÉVALUATION DE L’OPÉRABILITÉ FONCTIONNELLE
INOPÉRABLE PNEUMONECTOMIE
RÉSECTION JUSQU’AU
NIVEAU CALCULÉ
DIAGNOSTIC
• ECG d’effort
• Écho
• TI201 Tc99 m
• Cathéter
TRAITEMENT
• médical
• chirurgical
CŒUR
• Anamnèse
• ECG
POUMONS
• VEMS
• DLCO
FONCTION RÉGIONALE
VO2 max ppo
FONCTION RÉGIONALE
• VEMS ppo
• DLCO ppo
TEST À L’EFFORT
• VO2 max
•
positive
oui
positive
non
négative négative
un des deux < 80 % les deux ³ 80 %
40-75 % et
10-20 ml/kg/mn
< 40 % ou
< 10 ml/kg/mn
les deux < 40 %
< 35 % ou
< 10 ml/kg/mn
> 75 % ou
> 20 ml/kg/mn
un des deux ³ 40 %
³ 35 % ou
³ 10 ml/kg/mn
Figure 2. Algorithme pour l’évaluation des réserves cardiorespiratoires
d’un malade devant bénéficier d’une résection pulmonaire. TI :
thallium ; Tc : technétium ; V
.O2max : consommation maximale d’oxy-
gène ; ppo : valeur prédite postopératoire.

RÉFÉRENCES BIBLIOGRAPHIQUES
1. Wyser C., Bolliger C.T. Smoking-related disorders. In : The tobacco epide-
mic. Prog Respir Res. Bolliger C.T., Fagerström K.O. (eds), Karger A.G., Basel,
1997.
2. Doll R., Peto R., Wheatley K., Gray R., Sutherland I. Mortality in relation to
smoking : 40 years’ observation on male British doctors. Br Med J 1994 ; 309 :
901-11.
3. Bates M. Results of surgery for bronchial carcinoma in patients aged 70 and
over. Thorax 1970 ; 25 : 77-8.
4. Nagasaki F., Flehinger B.J., Martini N. Complications of surgery in the
treatment of carcinoma of the lung. Chest 1982 ; 82 : 25-9.
5. Didolkar M.S., Moore R.H.,Takita H. Evaluation of the risk in pulmonary
resection for bronchogenic carcinoma. Am J Surg 1974 ; 127 : 700-3.
6. Gerson M.C., Hurst J.M., Hertzberg V.S., Doogan P.A., Cochran M.B., Lim
S.P., McCall N., Adolph R.J. Cardiac prognosis in noncardiac geriatric surgery.
Ann Internal Med 1985 ; 103 : 832-7.
7. Goldman L., Caldera D.L., Nussbaum S.R., Southwick F.S., Krogstad D.,
Murray B., Burke D.S., O’Malley T.A., Goroll A.H., Caplan C.H., Nolan J.,
Carabello B., Slater E.E. Multifactorial index of cardiac risk in noncardiac sur-
gical procedures. N Engl J Med 1977 ; 297 : 845-50.
8. Steen P.A., Tinker J.H., Tarhan S. Myocardial reinfarction after anesthesia
and surgery. JAMA 1978 ; 239 : 2566-70.
9. Boushy S.F., Billig D.M., North L.B., Helgason A.H. Clinical course related
to preoperative and postoperative pulmonary function in patients with broncho-
genic carcinoma. Chest 1971 ; 59 : 383-91.
10. Wernly J.A., DeMeester T.R., Kirchner P.T., Myerowitz P.D., Oxford D.E.,
Golomb H.M. Clinical value of quantitative ventilation-perfusion lung scans in
the surgical management of bronchogenic carcinoma. J Thorac Cardiovasc
Surg 1980 ; 80 : 535-43.
11. Cander L. Physiologic Assessment and management of the preoperative
patient with pulmonary emphysema. Am J Cardiol 1963 ; 12 : 324-6.
12. Ferguson M.K., Little L., Rizzo L., Popovich K.J., Glonek G.F., Leff A.,
Manjoney D., Little A.G. Diffusing capacity predicts morbidity and mortality
after pulmonary resection. J Thorac Cardiovasc Surg 1988 ; 96 : 894-900.
13. Wang J., Olak J., Ultmann R.E., Ferguson M.K. Assessment of pulmonary
complications after lung resection. Ann Thorac Surg 1999 ; 67 : 1444-7.
14. Markos J., Mullan B.P., Hillman D.R., Musk A.W., Antico V.F., Lovegrove
F.T., Carter M.J., Finucane K.E. Preoperative assessment as a predictor of
mortality and morbidity after lung resection. Am Rev Respir Dis 1989 ; 139 :
902-10.
15. Meyer-Erkelenz J.D., Mösges R., Sieverts H. Spiroergometrie (kardio-pul-
monale Funktion unter Belastung). Prax Pneumol 1980 ; 34 : 585-600.
16. Morice R.C., Peters E.J., Ryan M.B., Putnam J.B., Ali M.K., Roth J.A. Exer-
cise testing in the evaluation of patients at high risk for complications from lung
resection. Chest 1992 ; 101 : 356-61.
17. Damhuis R.A.M., Schütte P.R. Resection rates and postoperative mortality
in 7 899 patients with lung cancer. Eur Respir J 1996 ; 9 : 7-10.
18. Pierce R.J., Copland J.M., Sharpe K., Barter C.E. Preoperative risk evalua-
tion for lung cancer resection : predicted postoperative product as a predictor
of surgical mortality. Am Rev Respir Dis 1994 ; 150 : 947-55.
19. Bolliger C.T., Wyser C., Roser H., Solèr M., Perruchoud A.P. Lung scan-
ning and exercise testing for the prediction of postoperative performance in
lung resection candidates at increased risk for complications. Chest 1995 ;
108 : 341-8.
20. Nakahara K., Monden Y., Ohno K., Miyoshi S., Maeda H., Kawashima Y.
A method for predicting postoperative lung function and its relation to postope-
rative complications in patients with lung cancer. Ann Thorac Surg 1985 ; 39 :
260-5.
21. Olsen G.N., Bolton J.W.R., Weiman D.S., Hornung C.A. Stair climbing as
an exercise test to predict the postoperative complications of lung resection.
Chest 1991 ; 99 : 587-90.
22. Bechard D.,Wetstein L. Assessment of exercise oxygen consumption as
preoperative criterion for lung resection. Ann Thorac Surg 1987 ; 44 : 344-9.
23. Bolliger C.T., Jordan P., Solèr M., Stulz P., Grädel E., Skarvan K., Elsasser S.,
Gonon M., Wyser C., Tamm M., Perruchoud A.P. Exercise capacity as a predic-
tor of postoperative complications in lung resection candidates. Am J Respir
Crit Care Med 1995 ; 151 : 1472-80.
24. Wyser C., Stulz P., Solèr M., Tamm M., Müller-Brand J., Habicht J., Perru-
choud A.P., Bolliger C.T. Prospective evaluation of an algorithm for the functio-
nal assessment of lung resection candidates. Am J Respir Crit Care Med 1999 ;
159 ; 1450-6.
25. Tovar E.A. Minimally invasive approach for pneumonectomy culminating
in an outpatient procedure. Chest 1998 ; 114 : 1454-8.
26. Cooper J.D., Trulock E.P., Triantafillou A.N., Patterson G.A., Pohl M.S.,
Deloney P.A., Sundaresan R.S., Roper C.L. Bilateral pneumectomy (volume
reduction) for chronic obstructive pulmonary disease. J Thorac Cardiovasc
Surg 1995 ; 109 : 106-19.
27. McKenna R.J., Fischel R.J., Brenner M., Gelb A.F. Combined operations
for lung volume reduction surgery and lung cancer. Chest 1996 ; 110 : 885-8.
28. Ojo T.C., Martinez F., Paine R. III, Christensen P.J., Curtis J.L., Weg J.G.,
Kazerooni E.A., Whyte R. Lung volume reduction surgery alters management of
pulmonary nodules in patients with severe COPD. Chest 1997 ; 112 : 1494-500.
213
La Lettre du Pneumologue - Vol. II - n° 6 - décembre 1999
1
/
5
100%