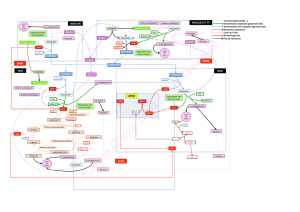
Réactions par transfert électronique

Chimie et Matériaux Inorganiques
7 – Réactivité des complexes
Réactions par transfert électronique
Henri Taube, Nobel de Chimie 1983
Rudolf Marcus, Nobel de Chimie 1992

7 - Réactions par transfert électronique
I. Redox
vs
substitution
1. Stabilités thermodynamique et cinétique
2. Réactions de transfert d’électron
II. Transfert électronique par sphère externe
1. Mécanisme
2. Principe de Franck-Condon
3. Facteurs influant la cinétique
9 taille des ions.
9 configuration de spin des ions
9 nature des ligands
4. Rationaliser le mécanisme de sphère externe : théorie de Marcus-Husch
9 Réaction d’échange
9 Réaction croisée
9 Un peu d’exercice
III. Transfert électronique par sphère interne
1. Mécanisme
2. Etapes limitantes…
3. Effet du ligand : classification de Robin-Day
9 Classe I, métalloprotéines
9 Classe II, bleu de Prusse
9 Classe III, liaison métal-métal
9 Un peu d’exercice…
4. Comment distinguer sphère externe / sphère interne
9 Un peu d’exercice…

e- Transfert de charge
:
transition électronique entre OA ou OM d’atomes différents
MMCT (intervalence)
(saphir)
Fe
2+
→
Ti
4+
LMCT
(KMnO
4
)
O
→
Mn
MLCT
(Ru(bpy)
3
2+
)
Ru
→
bpy
+ intense qu’une transition
d-d
(ε> 103)
+ énergétique (visible-UV)
E
CT = 580 nm (abs. jaune)
approche solide
Fe2+
d
6: t2g4eg2
Ti4+
d
0: t2g0eg0
Fe3+
d
5: t2g4eg1
Ti3+
d
1: t2g0eg1
approche moléculaire
[Fe(H2O)6]2+ + [Ti(H2O)6]4+⇄[Fe(H2O)6]3+ + [Ti(H2O)6]3+
?
I – Redox
vs
Substitution

Processus chimiques
déplacement d’électron(s) déplacement de noyau(x) et d’électron(s)
réaction par transfert d’électron changement de la distribution spatiale
(environnement) du noyau
[Cu(H2O)4]2+ + 4NH3⇄[Cu(NH3)4]2+
Chimie : reflet du changement des interactions entre particules de
charge opposée = ‘déplacement de charge’
[Fe(NH3)6]3+ + e ⇄[Fe(NH3)6]2+
Très rapide !!!
[Co(H2O)6]3+ + [Fe(H2O)6]2+ ⇄[Co(H2O)6]2+ + [Fe(H2O)6]3+
En général, les deux processus existent mais redox souvent trop rapide pour être détecté
Conditions de l’étude ?
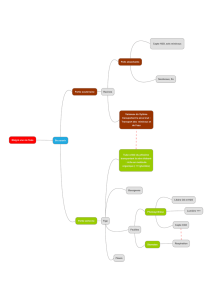
Propriétés électroniques et réactivité des complexes inorganiques

Keq
∆G°, Keq
∆G≠,
k,
t1/2
Stabilité thermodynamique
(stable
vs
instable)
énergie d’une réaction de formation
ou de décomposition = existence d’un
composé à l’équilibre
Stable : ∆G° > 0 (pas de réaction !), Keq faible
Stabilité cinétique (= réactivité)
(inerte
vs
labile)
vitesse à laquelle une réaction se produit
Inerte :
k
faible, t1/2 élevé,
∆G≠très élevée
k
I. 1. – Stabilités thermodynamique et cinétique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%






![[ ][][ MLn L M 10.3,6 ]) ([ ] [] [ = × = NH Ag NH Ag Kd](http://s1.studylibfr.com/store/data/002601672_1-57de8b0d2e37b3f5af3073b29cc142bc-300x300.png)