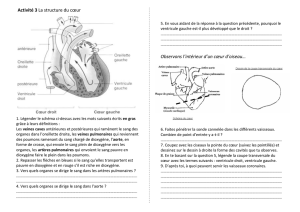
Exercices tableau d`avancement

Exercices tableau d’avancement
I. Bosses de chameau :
Les chameaux emmagasinent de la tristéarine (C57H110O6) dans leurs bosses. Cette graisse est à la fois
une source d'énergie et une source d'eau, car, lorsqu'elle est utilisée, il se produit une réaction
identique à la combustion : la tristéarine réagit avec le dioxygène de l'air pour donner du dioxyde de
carbone et de l'eau.
1. Ecrire l'équation chimique correspondante.
2. Au moyen d'un tableau d’avancement, déterminer les quantité (en moles) de dioxygène nécessaire
et d'eau libérée au cours de cette transformation qui ferait réagir 1,0kg de stéarine.
3. En déduire la masse d'eau formée.
4. Dans les conditions de "l'expérience", le volume molaire d'un gaz est : Vmol=24L.mol-1.
Calculer le volume de dioxygène nécessaire à cette combustion (1kg de stéarine).
II. Production du métal zinc :
Dans la nature, l’élément zinc se trouve essentiellement sous forme d’un minerai appelé « blende » : le
sulfure de zinc. C’est à partir de ces gisements qu’on produit le métal fer par la méthode suivants : on
commence par faire réagir le sulfure de zinc avec le dioxygène, ce qui conduit à la formation d’oxyde de
zinc et de dioxyde de soufre ; puis on obtient le métal zinc en faisant réagir de l’oxyde de zinc avec du
carbone ; au cours de cette dernière réaction, il se forme aussi du monoxyde de carbone.
1. Sachant que le sulfure de zinc et l’oxyde de zinc sont des composés ioniques, donner leurs formules
chimiques.
2. Donner les formules des molécules : dioxygène, dioxyde de soufre, monoxyde de carbone.
3. Ecrire, dans l’ordre, les réactions qui permettent d’obtenir le zinc à partir de la blende.
Rappels : ion zinc : Zn2+ ion oxygène : O2- ion sulfure : S2-
III. Eau oxygénée :
Le flacon utilisé dans cette étude porte la mention suivante : eau oxygénée à 10 volumes. Cette indication
est appelée le titre de l'eau oxygénée.
Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution
aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation :
2 H2O2 (aq) 2 H2O(l) + O2 (g)
L'eau oxygénée du commerce se présente en flacons opaques afin d'éviter que la lumière favorise la
transformation chimique précédente.
On désire vérifier l'indication donnée sur le flacon concernant le titre de l'eau oxygénée de la solution
commerciale utilisée.
1. Par définition du titre de l'eau oxygénée, quel volume de dioxygène V(O2) serait libéré par un volume
V=1,00L de la solution commerciale au cours de la réaction de dismutation du peroxyde d'hydrogène
?
2. Calculer la quantité de dioxygène formé au cours de cette transformation.
3. En utilisant le tableau d’avancement suivant, déterminer la quantité de peroxyde d’hydrogène
nécessaire pour produire la quantité de dioxygène calculée.
4. Vérifier que la concentration en peroxyde d'hydrogène notée [H2O2] de cette solution commerciale a
pour valeur : [H2O2] = 8,0.10-1mol.L-1.
5. Exprimer cette concentration en pourcentage massique (pourcentage en masse de peroxyde
d’hydrogène dans la solution).
On considère que la masse volumique de l’eau oxygénée est équivalente à celle de l’eau, soit
μ=1000g.L-1.

Exercices tableau d’avancement
I. Bosses de chameau :
Les chameaux emmagasinent de la tristéarine (C57H110O6) dans leurs bosses. Cette graisse est à la fois
une source d'énergie et une source d'eau, car, lorsqu'elle est utilisée, il se produit une réaction
identique à la combustion : la tristéarine réagit avec le dioxygène de l'air pour donner du dioxyde de
carbone et de l'eau.
1. Ecrire l'équation chimique correspondante.
2. Au moyen d'un tableau d’avancement, déterminer les quantité (en moles) de dioxygène nécessaire
et d'eau libérée au cours de cette transformation qui ferait réagir 1,0kg de stéarine.
3. En déduire la masse d'eau formée.
4. Dans les conditions de "l'expérience", le volume molaire d'un gaz est : Vmol=24L.mol-1.
Calculer le volume de dioxygène nécessaire à cette combustion (1kg de stéarine).
II. Production du métal zinc :
Dans la nature, l’élément zinc se trouve essentiellement sous forme d’un minerai appelé « blende » : le
sulfure de zinc. C’est à partir de ces gisements qu’on produit le métal fer par la méthode suivants : on
commence par faire réagir le sulfure de zinc avec le dioxygène, ce qui conduit à la formation d’oxyde de
zinc et de dioxyde de soufre ; puis on obtient le métal zinc en faisant réagir de l’oxyde de zinc avec du
carbone ; au cours de cette dernière réaction, il se forme aussi du monoxyde de carbone.
1. Sachant que le sulfure de zinc et l’oxyde de zinc sont des composés ioniques, donner leurs formules
chimiques.
2. Donner les formules des molécules : dioxygène, dioxyde de soufre, monoxyde de carbone.
3. Ecrire, dans l’ordre, les réactions qui permettent d’obtenir le zinc à partir de la blende.
Rappels : ion zinc : Zn2+ ion oxygène : O2- ion sulfure : S2-
III. Eau oxygénée :
Le flacon utilisé dans cette étude porte la mention suivante : eau oxygénée à 10 volumes. Cette indication
est appelée le titre de l'eau oxygénée.
Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution
aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation :
2 H2O2 (aq) 2 H2O(l) + O2 (g)
L'eau oxygénée du commerce se présente en flacons opaques afin d'éviter que la lumière favorise la
transformation chimique précédente.
On désire vérifier l'indication donnée sur le flacon concernant le titre de l'eau oxygénée de la solution
commerciale utilisée.
1. Par définition du titre de l'eau oxygénée, quel volume de dioxygène V(O2) serait libéré par un volume
V=1,00L de la solution commerciale au cours de la réaction de dismutation du peroxyde d'hydrogène
?
2. Calculer la quantité de dioxygène formé au cours de cette transformation.
3. En utilisant le tableau d’avancement suivant, déterminer la quantité de peroxyde d’hydrogène
nécessaire pour produire la quantité de dioxygène calculée.
4. Vérifier que la concentration en peroxyde d'hydrogène notée [H2O2] de cette solution commerciale a
pour valeur : [H2O2] = 8,0.10-1mol.L-1.
5. Exprimer cette concentration en pourcentage massique (pourcentage en masse de peroxyde
d’hydrogène dans la solution).
On considère que la masse volumique de l’eau oxygénée est équivalente à celle de l’eau, soit
μ=1000g.L-1.
1
/
2
100%