Stratégie préopératoire chez le coronarien (examens et traitements)

STRATÉGIE PRÉOPERATOIRE
CHEZ LE CORONARIEN
(EXAMENS ET TRAITEMENTS)
Vincent Piriou
Service d’Anesthésie Réanimation. Centre Hospitalier Lyon Sud.
69495 Lyon Pierre Bénite.
E-mail : [email protected]
INTRODUCTION
Le risque cardiaque peri-opératoire concerne les patients présentant des
antécédents de coronaropathie, d’insuffisance cardiaque, de valvulopathie
(notamment les valvulopathies sténosantes) et les patients présentant des
cardiopathies congénitales. La fréquence des infarctus du myocarde péri-
opératoires est bien connue en chirurgie vasculaire (environ 5 % des patients) [1].
En dehors de la chirurgie vasculaire, la fréquence des infarctus du myocarde
péri-opératoires est moins bien connue, on l’estime à environ 1 % en chirurgie
orthopédique, cette fréquence s’accroissant avec l’âge [2]. La dernière étude de
mortalité SFAR-INSERM 2003 [3] a montré que les décès d’origine cardiaque
sont une cause importante de mortalité péri-opératoire notamment les chocs
cardiogéniques par infarctus du myocarde. La mortalité de l’infarctus du myocarde
postopératoire est plus importante que la mortalité de l’infarctus du myocarde
médical. Il existe une relation dose-dépendante entre le pic de Troponine I
postopératoire et la mortalité à 6 mois [4]. La mortalité des infarctus du myocarde
postopératoire immédiate est relativement faible. Cependant, cette mortalité
s’accroît dans les mois qui suivent la chirurgie [5]. On comprend donc l’importance
de prévenir ces infarctus du myocarde par des examens complémentaires préo-
pératoires (= stratification péri-opératoire) et des traitements cardio-protecteurs
afin d’améliorer la survie à long terme de ces patients.
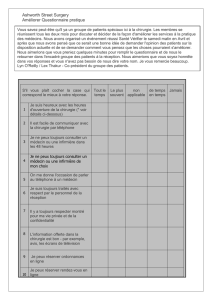
1. STRATIFICATION PRÉOPÉRATOIRE (FIGURE 1)
L’évaluation préopératoire a pour but de diminuer la morbi-mortalité péri-
opératoire avec une dépense minimale en ce qui concerne les examens
préopératoires et de concentrer les moyens économiques sur les patients à haut
risque chez lesquels les examens préopératoires modifient la conduite à tenir,
permettant d’améliorer la survie à long terme.

MAPAR 2006
62
Figure 1 : Stratification préopératoire
Le risque cardiaque du patient anesthésié dépend du risque lié à l’état phy-
siologique du patient, de sa capacité à réaliser un effort, et du risque chirurgical.
L’American College of Cardiology et l’American Heart Association ont édité des
recommandations concernant la stratification préopératoire des patients à risque
cardiaque, ces recommandations ont été éditées en 1996 et revues en 2002 [6].
Ces recommandations sont assez lourdes à mettre en œuvre et pourvoyeuses
de nombreux examens complémentaires souvent inutiles. L’évaluation cardiaque
préopératoire nécessite une parfaite collaboration entre les anesthésistes, les
chirurgiens, et les cardiologues qui doivent être impliqués et qui doivent avoir
les connaissances de la prise en charge péri-opératoire des patients à risque
cardiaque.
CONSULTATION D'ANESTHESIE
• Interrogatoire
• Examen clinique
• Score de risque clinique (score de Lee)
• Recherche de la tolérance à l'effort
• Recherche et caractérisation d'un angor d'effort
Score de Lee élevé et/ou
forte suspicion clinique
d'une coronaropathie sévère
Consultation de cardiologie avec
examens complémentaires de stress
échocardiographie à la dobutamine
ou scintigraphie thallium/dipyridamole
Chirurgie sous ß-bloquants
± statine ou rien
Test fortement positif
suggérant une atteinte coronarienne
sévère
(sténose TCG, tritronculaire)
Discussion multidisciplinaire d'une
coronarograhie pour envisager une
éventuelle revascularisation
préopératoire définissant les
avantages et inconvénients potentiels.
Test négatif ou faiblement positif
ne suggérant pas une atteinte
coronarienne très sévère
• Chirurgie sous ß-bloquants
± statine
• Surveillance hémodynamique péri-
opératoire
• Monitorage électrique du segment
ST et biologie (TnI)
NON
OUI

Jouons-nous un rôle dans le devenir de nos patients à long terme ?
63
Dans tous les cas, le risque cardiaque sera évalué lors de la consultation
d’anesthésie par l’interrogatoire soigneux du patient à la recherche des facteurs
de risque, à la recherche de la tolérance à l’effort qui devra être renseignée sur
la feuille d’anesthésie (il faut savoir si le patient est capable de réaliser un effort
habituel correspondant à 4 équivalents métaboliques tel que monter un escalier
avec un panier à provision). L’examen clinique devra être réalisé, ainsi qu’un élec-
trocardiogramme de repos qui renseignera sur la présence de troubles du rythme
et sur la présence d’ondes Q séquellaires d’un infarctus du myocarde ancien,
mais en aucun cas sur la présence d’une coronaropathie actuelle. L’interrogatoire
devra faire préciser l’existence d’une coronaropathie décompensée ou non, le
traitement habituel du patient, les antécédents d’insuffisance cardiaque gauche
congestive, et faire rechercher quelles sont les causes de cette décompensation
cardiaque (poussée d’HTA, passage en AC/FA…).
Les situations cliniques qui présentent un risque majeur sont le syndrome
coronarien aigu récent (infarctus du myocarde de moins de 30 jours ou angor ins-
table ou sévère), l’insuffisance cardiaque décompensée, les arythmies graves ou
les valvulopathies sévères, notamment les valvulopathies sténosantes aortiques.
Toutes ces situations doivent conduire à annuler la chirurgie réglée ou semi-réglée
et à adresser rapidement le patient vers une consultation de cardiologie afin de
rééquilibrer le patient. Les patients à risque intermédiaire sont les patients qui
présentent un angor stable, les patients présentant un infarctus du myocarde de
plus de 30 jours, les patients présentant une insuffisance cardiaque actuellement
compensée, les patients diabétiques ou présentant une insuffisance rénale. Les
patients à risque modéré sont des patients qui présentent une hypertension
artérielle, une arythmie cardiaque, un trouble de conduction intra-ventriculaire,
un âge supérieur à 70 ans ou une hypertrophie ventriculaire gauche. Les chirur-
gies à risque sont représentées par des interventions réalisées en urgence, par
la chirurgie vasculaire, notamment la chirurgie supra-inguinale et par toutes les
chirurgies qui présentent des variations volémiques importantes.
Lors de la consultation d’anesthésie, l’anesthésiste a pour mission de
dépister par l’interrogatoire et l’examen clinique les patients qui ont un risque
important de présenter une complication cardiaque postopératoire et de mettre
en œuvre des mesures pour prévenir ce risque.
Les anesthésistes peuvent s’aider de scores de risque tel que le score décrit
par Thomas Lee en 1999 [7]. Bien que ce score ne tienne pas compte de l’âge, de
la présente d’une valvulopathie sténosante, du rythme cardiaque ou du caractère
urgent de la chirurgie, ce score a le mérite de prendre en compte différentes
pathologies et le risque lié à la chirurgie. Ce score a été validé pour différents
types de chirurgie : chirurgie vasculaire centrale, chirurgie vasculaire périphérique,
chirurgie thoracique, chirurgie abdominale, chirurgie orthopédique…
Les facteurs de risque compris dans ce score sont :
• La chirurgie à haut risque (intra-péritonéale, intra-thoracique ou vasculaire).
• Les antécédents de cardiopathies ischémiques non revascularisées.
• Les antécédents d’insuffisance cardiaque congestive.
• Les antécédents d’accident vasculaire cérébral ou d’accident ischémique
transitoire.
• Les antécédents de diabète insulinodépendant.
• Les antécédents d’insuffisance rénale.

MAPAR 2006
64
Plus les patients cumulent les facteurs de risque, plus le risque de présenter
un évènement cardiaque péri-opératoire est important.
En fonction du risque lié au patient, du risque lié à la chirurgie, de la capacité
du patient à réaliser un effort, et de son score de risque clinique, l’anesthésiste
pourra apprécier le risque de présenter une complication postopératoire. Si ce
risque semble modéré, un traitement préventif médicamenteux (ß-bloquants,
statines) pourra suffire. Si ce risque semble très important, et si le patient a une
suspicion de coronaropathie sévère dont il faudra envisager la revascularisation
éventuelle, alors dans ce cas, un examen de stress non invasif pourra permettre
de quantifier la sévérité de l’atteinte coronarienne. Le clinicien a le choix entre
faire réaliser une échocardiographie de stress à la dobutamine et une scintigra-
phie myocardique au thallium-dipyridamole. La tendance actuelle est de préférer
l’échocardiographie de stress à la scintigraphie du fait de son coût faible, de sa
disponibilité, de l’absence d’exposition aux produits radioactifs. De plus, une
méta-analyse a montré une meilleure sensibilité et une meilleure spécificité de
l’échocardiographie de stress pour prédire les complications péri-opératoires [8].
L’échocardiographie de stress va permettre de quantifier la coronaropathie en
fonction du nombre de segments anormaux.
Lorsque l’examen de stress préopératoire est positif, faut-il envisager une
revascularisation coronarienne préopératoire avant la chirurgie ? L’étude CARP
a montré dans le cadre d’une étude randomisée que la revascularisation systé-
matique préopératoire des patients présentant un examen de stress positif est
inutile [9]. Cependant, les patients les plus graves, tels que les patients présentant
une sténose du tronc commun gauche n’ont pas été inclus dans cette étude. En
2001, Boersma a montré que les ß-bloquants sont d’autant plus efficaces que
les patients ont des facteurs de risque [10]. Cependant, les ß-bloquants ne sont
plus efficaces lorsque les patients cumulent les facteurs de risque et qu’ils ont
une échocardiographie de stress fortement positive, ceci correspond aux patients
présentant probablement soit une sténose du tronc commun gauche, soit une
atteinte tritronculaire, ces patients représentent un nombre très restreint chez
lesquels une revascularisation est probablement envisageable.
Ainsi, il faut donc considérer une revascularisation préopératoire chez les
patients qu’on aurait revascularisé en dehors du contexte chirurgical, c’est-à-dire
tous les patients qui présentent un angor d’effort important à l’interrogatoire
et chez qui on a une suspicion d’atteinte coronarienne proximale ou étendue.
Bien que l’intérêt de la revascularisation préopératoire ne soit pas démontré, la
question doit être envisagée dans un contexte multidisciplinaire.
Plutôt que de réaliser des examens de stress non invasifs inutiles et trop
nombreux, Grayburn et al [11] préconise avant tout de réaliser des scores
cliniques et d’envisager des examens complémentaires en posant la question
suivante : feriez-vous une coronarographie ou une revascularisation en dehors
du contexte chirurgical ? Si la réponse est non, un traitement par ß-bloquants et
éventuellement statines pourrait être suffisant. Il faut garder à l’esprit que les
examens de stress non invasifs sont caractérisés par une forte valeur prédictive
négative, aux alentours de 90 % (ce qui fait que lorsque l’examen est négatif,
on peut réaliser l’intervention chirurgicale sans risque), mais aussi par une très
faible valeur prédictive positive, d’environ 20 à 30 %.

Jouons-nous un rôle dans le devenir de nos patients à long terme ?
65
2. STRATÉGIE DE TRAITEMENT PRÉOPÉRATOIRE
2.1. ß-BLOQUANTS
A partir de la littérature de cardiologie médicale il y a de forts arguments
pour penser que les ß-bloquants sont efficaces pour protéger le myocarde de
l’infarctus. Les ß-bloquants agissent en rééquilibrant les apports et les besoins
en oxygène du myocarde, et en favorisant la redistribution du flux sanguin des
zones épicardiques vers les zones sous-endocardiques qui sont les plus à risque.
Jusqu’à peu, seules 5 études randomisées avaient étudié l’effet des ß-bloquants
sur les évènements cardiaques périopératoires [12]. Mangano, dans une étude
très célèbre publiée en 1996, a montré que lorsque de l’Atenolol (Tenormine®)
était administré par voie intraveineuse juste avant l’intervention chirurgicale avec
un objectif de fréquence cardiaque entre 55 et 65 bpm, et bien que la mortalité
hospitalière soit identique, la mortalité à 6 mois, un an et deux ans était en faveur
du traitement par ß-bloquants [13].
Par la suite, Poldermans a montré en 1999, parmi une population de corona-
riens extrêmement sélectionnés (112 coronariens opérés en chirurgie vasculaire
avec un test d’effort positif), qu’une prophylaxie des complications cardiaques
péri-opératoires par un traitement par du Bisoprolol débuté lors de la consulta-
tion d’anesthésie entraînait une diminution de la morbi-mortalité très importante
(34,3 % vs 3,4 % à 28 jours) [14]. Cet effet persistait et s’accroissait pendant
au moins 18 mois [14, 15]. Or, depuis 2005, aucune nouvelle étude randomisée
n’est parue dans la littérature et un certain nombre d’auteurs se sont posés la
question du rationnel scientifique de la prescription généralisée des ß-bloquants
en péri-opératoire [16, 17].
Des études très récentes ont nuancé l’utilisation des ß-bloquants chez les
patients coronariens. Suite à l’étude de 1996 de Mangano qui avait montré dans
l’analyse de sous-groupe des 63 patients diabétiques inclus dans son étude, que
l’Atenolol avait un effet important d’amélioration de la survie à 2 ans (+ 75 %),
l’étude DiPOM (Diabetic Post-Operative Morbidity and mortality) a montré dans
un essai multicentrique contrôlé randomisé en double aveugle chez 921 patients
diabétiques insulino-dépendants et non insulino-dépendants, que la morbi-
mortalité d’origine cardiaque était identique, que les patients soient ß-bloqués
par du Métoprolol ou par un placebo. Les auteurs concluent à l’absence d’effet
des ß-bloquants en péri-opératoire sur la seule indication du diabète [18, 19].
Une seconde étude parue pour l’instant sous forme d’abstract, l’étude MaVS
(Metoprolol after Vascular Surgery) a montré sur 497 patients l’absence d’effet
des ß-bloquants chez ces patients, par contre, il a été montré l’existence d’effets
indésirables tels que bradycardie et hypotension chez les patients ayant reçu
des ß-bloquants [20].
Une méta-analyse de Devereaux et al publiée en août 2005 a montré que,
même en tenant compte des deux études précédentes, les données actuelles
publiées pour mettre en évidence un effet du traitement par ß-bloquants sont
insuffisantes pour conclure à un possible effet. En compilant toutes les études
de haut grade sur les ß-bloquants en péri-opératoire, les auteurs montrent un
risque relatif de bradycardie plus important sans pouvoir montrer de diminution
du risque relatif d’évènements cardiovasculaires péri-opératoires [21].
 6
6
 7
7
 8
8
 9
9
1
/
9
100%