Colle d`UE 3 – Le 09/02 - Tutorat Santé Lorraine

© Tutorat Santé 2016/2017 - Reproduction interdite, même partielle. Page 1 sur 6
Vous avez 50 minutes pour répondre à 40 QCM.
1) À propos de la dualité onde-corpuscule de la lumière :
A) Toute particule se comporte comme une onde et réciproquement.
B) On a mis en évidence l’aspect corpusculaire de la lumière par
rayonnement du corps noir et par effet photochimique.
C) La diffraction et les interférences mettent en évidence l’aspect
ondulatoire de la lumière.
D) La lumière est un flux de photons d’énergie
, avec h la
constante de Planck, c la vitesse de la lumière et λ la longueur
d’onde.
E) La relation de Broglie indique que la longueur d’onde d’une
particule équivaut au rapport dela quantité de mouvement de cette
particule sur la constante de Planck.
2) On considère l’axe x sur lequel se propagent un champ
magnétique
et un champ électrique
. Pour une onde
électromagnétique :
A)
,
et x sont parallèles entre eux : l’onde est longitudinale.
B) (
,
, x) est un trièdre indirect.
C) Si le maximum de
est atteint, le maximum de
est atteint.
D) Le maximum de
est atteint quand le minimum de
l’est.
E)
et
vibrent de façon sinusoïdale, à la même fréquence.
3) Concernant la vibration sinusoïdale de deux ondes de même longueur
d’onde λ :
1 2 3
A) représente la différence de marche entre les ondes.
B) Concernant l’image 1, les ondes sont en phase tel que = 2qπ (q
entier).
C) Concernant l’image 2, les ondes sont en opposition de phase tel
que = (2q+1)π (q entier).
D) Concernant l’image 3, la différence de marche entre les ondes vaut
qλ (q entier).
E) Concernant l’image 3, la différence de marche entre les ondes est
forcément nulle.
4) À propos de la diffusion :
A) Elle peut se faire uniquement grâce à un obstacle surfacique (cas du
verre dépoli).
B) Elle est dépendante de la taille des particules en suspension.
C) La diffusion de Mie diffuse plus de bleu et transmet plus de rouge.
D) La diffusionde Rayleighexplique la couleur des nuages.
E) La néphélométrie étudie l’intensité diffusée, notamment dans la
détermination de la concentration en protéines.
5) On veut déterminer, grâce à la loi de Cauchy, l’indice du verre pour
une longueur d’onde de couleur verte (λ = 500 nm). On prendra
comme valeurs a = 1.5 et b = 4000 USI :
A) Dans la Loi de Cauchy, λ2 est inversement proportionnel à n.
B) On obtient n = 1.516.
C) On obtientn = 1.660.
D) On obtient n = 3.100.
E) La Loi de Cauchy s’utilise pour un milieu dispersif.
Colle d’UE 3 – Le 09/02

© Tutorat Santé 2016/2017 - Reproduction interdite, même partielle. Page 2 sur 6
6) On s’intéresse à la réfraction d’une onde lumineuse passant d’un
milieu transparent d’indice de réfraction n1 à un milieu transparent
d’indice de réfraction différent n2. On appelle r l’angle de réfraction et
i l’angle incident :
A) La Loi de Descartes peut s’écrire :
.
B) Si n1<n2, il est possible d’avoir une réflexion totale.
C) Si n1>n2, il est possible de produire une émergence dite rasante.
D) Si n1<n2, il est possible de produire uneémergence dite rasante.
E) Dans un endoscope, le principe de réflexion totale de la fibre
optique démontre que la gaine est plus réfringente que le cœur.
7) Madame Pichon, en panne au milieu de la route et dans le brouillard,
allume les phares en verre (d’indice de réfraction n1 = 1,5) de sa
superbe Chevrolet Eurosport et décide d’attendre les secours en
calculant les intensités réfléchie Ir et transmise It par rapport à la
lumière incidente d’intensitéI0venant de ses phares. On prendra pour
n2 l’indice de réfraction de l’air. On a :
A) Ir = 25% I0
B) Ir = 4% I0
C) It = 4% I0
D) It= 96%I0
E) La somme de It et Ir ne vaut pas I0 à cause du brouillard.
Les 2 QCM suivants forment un exercice commun.
8) On souhaite réaliser la diffraction d’une source monochromatique
issue d’un laser de longueur d’onde λ = 0.6µm sur un écran placé à D =
150 cm à partir de fentes d’Young dont la distance entre les fentes est
de a = 0.2mm.On souhaite déterminer l’interfrange i :
A)
B)
C) i = 8 mm
D) i = 45 mm
E) i = 4.5 mm
9) On s’intéresse aux caractéristiques de cette diffraction sur l’écran :
A) Les franges sont des tâches lumineuses équidistantes dont le centre
correspond à une intensité lumineuse maximale I = Imax.
B) L’interfrange correspond à la distance entre le milieu de deux
franges lumineuses consécutives.
C) Les interférences constructives se localisent au niveau des franges
sombres.
D) Les franges sombres sont en opposition de phase.
E) Pour voir un phénomène d’interférences, on peut aussi utiliser deux
sources lumineuses cohérentes qui doivent donc être de même
fréquence et avoir un déphasage nul.
10) Soit un réseau dont le pas est de 5µm pour une longueur totale de
10cm. Le nombre total de traits par mm sur ce réseau est :
A) 50000 traits.mm-1
B) 500 traits.mm-1
C) 200 traits.mm-1
D) 50 traits.mm-1
E) 20 traits.mm-1
11) À propos des lentilles :
A) Tout rayon incident qui passe par le centre optique est réfracté
parallèlement à l’axe optique.
B) Un exemple de lentille mince à bords épais est la lentille biconvexe.
C) Un exemple de lentille mince à bords épais est la lentille biconcave.
D) Dans les conditions de Gauss, l’objet est de petite taille.
E) Le foyer image d’une lentille mince à bords mince est le conjugué de
son foyer objet.
12) Soit une lentille mince biconvexe de centre optique O. Soit un objet
réel TE placé à 4 cm de O (T est sur l’axe optique). Soit T’ l’image de T
par rapport à la lentille telle que OT’ = 2 cm. On a :
A) La valeur algébrique de OT vaut -4cm.
B) Le grandissement est égal à 0,5.
C) La distance focale image est égale à 0,75 cm.
D) La vergence est égale à 75 .
E) L’image sera plus petite que l’objet.

© Tutorat Santé 2016/2017 - Reproduction interdite, même partielle. Page 3 sur 6
13) À propos du microscope optique :
A) La limite de résolution des microscopes optiques est de 0,2 .
B) L’image obtenue à travers un microscope optique est droite par
rapport à l’image obtenue par l’objectif.
C) Dans le microscope optique, l’oculaire joue le rôle de loupe.
D) Le microscope à fond clair donne une image foncée sur fond brillant.
E) Les objectifs à immersion utilisent un liquide d’immersion comme
de l’huile pour augmenter la limite de résolution du microscope
optique.
14) La puissance d’une loupe :
A) n’a pas d’unité.
B) s’exprime en dioptries.
C) correspond au rapport d’un angle sur une distance.
D) correspond au rapport de deux angles.
E) correspond au rapport de deux distances.
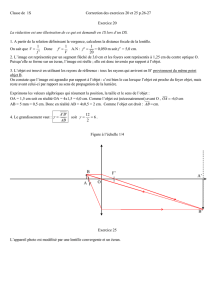
15) Soit deux objets A1B1 et A2B2 et une lentille convergente L. On sait que
EG est l’image de A1B1. On a alors :
A) CD est l’image de A2B2.
B) L’image de A2B2 est réelle.
C) Le point C est le foyer objet de la lentille.
D) Le grandissement de A1B1 par la lentille est égal à 1.
E) La distance focale image vaut -3 cm.
16) Ces éléments font partie d’un microscope confocal :
A) Anneau de phase
B) Détecteur
C) Objectif
D) Miroir semi-réfléchissant
E) Laser
17) Un objet situé entre le point focal objet d’une lentille biconvexe et le
centre optique donnera une image :
A) Droite
B) Renversée
C) Réelle
D) Virtuelle
E) Agrandie
18) Soit une lentille de vergence -2 de centre optique O. On place un
objet AB (A est sur l’axe optique) à -2 m de O en valeur algébrique. On
peut dire que :
A) La lentille est divergente.
B)
= -0,5 cm
C) L’image se forme à 4 m de O.
D) L’image est virtuelle.
E) Le grandissement est égal à 2.
19) Soit un objet AB et une lentille de centre optique O :

© Tutorat Santé 2016/2017 - Reproduction interdite, même partielle. Page 4 sur 6
A) Les points A et A3 sont conjugués.
B) Les points B et B4sont conjugués.
C) La vergence de la lentille est positive.
D) L’image de AB par la lentille est virtuelle.
E) L’image de AB par la lentille est plus petite.
20) À propos du prisme :
A) Le prisme se base sur le principe de la double réflexion.
B) Selon la loi de Beer-Lambert, le violet est plus dévié que le rouge.
C) Il s’agit d’un système dispersif.
D) Le pouvoir de résolution est de R = λ / Δλ, avec λ une longueur
d’onde donnée.
E) Le pouvoir de résolution du prisme augmente avec son pouvoir
dispersif.
21) À propos de ce spectre électromagnétique divisé en 4 domaines notés
(a), (b), (c) et (d) :
A) Le domaine du visible se trouve dans le domaine (a).
B) Dans le domaine (d) on retrouve notamment les micro-ondes.
C) Les rayons X se trouvent dans le domaine (a).
D) Le spectre du visible se trouve entre 400 et 800 µm.
E) Le domaine (c) correspond aux infrarouges.
22) La lumière est une vibration sinusoïdale qui s’exprime par la fonction
s(t) = s0 cos(ωt – ϕ) :
A) ϕ s’exprime en rad.
B) ω s’exprime en Hz.
C) ω est la pulsation.
D) s0 est l’amplitude maximale.
E) Le produit ωt est sans unité.
23) Les lasers :
A) provoquent grâce à leur cohérence un phénomène appelé speckle.
B) nécessitent une inversion de population pour fonctionner.
C) sont constitués de 2 miroirs semi-réfléchissants.
D) possèdent une cavité optique dont la longueur correspond à un
nombre entier de demi-longueurs d’ondes.
E) sont inoffensifs pour les yeux s’ils sont protégés par des lentilles
correctrices.
24) Un laser à argon émet un faisceau lumineux non divergent à une
longueur d’onde λ = 488 nm. Ce laser :
A) émet une couleur jaune-vert.
B) possède un milieu actif solide.
C) a une intensité égale à sa puissance divisée par la surface du
faisceau.
D) est utilisé dans le traitement des angiomes.
E) peut servir au pompage optique d’autres lasers.
25) À propos de la sécurité sur les lasers :
A) Les principaux dangers dépendent de la longueur d’onde, du temps
d’émission, de la puissance émise et de la focalisation du faisceau.
B) Le laser de classe 4 ne nécessite pas de protection particulière.
C) Le port de lunettes de protection est obligatoire pour le laser de
classe 1.
D) Il y a 8 classes de risques différentes dans la réglementation des
lasers.
E) La paupière se ferme pour protéger l’œil s’il est soumis à la lumière
infrarouge d’un laser.
26) Concernant la régulation des acides et des bases dans l’organisme :
A) Elle fait intervenir le système respiratoire.
B) Elle fait intervenir deux principaux systèmes tampons.
C) Les bicarbonates constituent la réserve alcaline de l’organisme.
D) Le système tampon acide carbonique / bicarbonates est dit fermé.
E) Le système hémoglobine intervient dans 60% du pouvoir tampon de
l’organisme.

© Tutorat Santé 2016/2017 - Reproduction interdite, même partielle. Page 5 sur 6
27) À propos des mécanismes rénaux assurant l’équilibre acido-basique :
A) Les reins assurent l’excrétion des acides volatils et la conservation
des tampons.
B) Le tampon bicarbonate est réabsorbé à 90% au niveau des tubes
proximaux.
C) La production de HCO3
- se fait en parallèle à la réabsorption d’H+.
D) Au niveau de l’anse de Henlé, le rein réabsorbe les K+ en échange de
H+.
E) L’acidose et l’hypokaliémie sont souvent associées.
28) À propos des troubles de l’état acido-basique :
A) Le pH physiologique est de 7,4 ± 0,2.
B) Une acidose métabolique peut être due à une augmentation de la
concentration en HCO3
-.
C) Une alcalose respiratoire peut être la conséquence d’une
diminution de la PaCO2.
D) La compensation d’une acidose respiratoire est une augmentation
de la concentration en bicarbonates.
E) La compensation d’une acidose métabolique est immédiate.
29) Un homme se présente aux urgences, on lui fait un gaz du sang qui
révèle les résultats suivants : pH = 7,25, PaCO2 = 24 mmHg, [HCO3
-] =
10 mmol/L. On peut dire que :
A) Le patient est en alcalose respiratoire compensée.
B) Le patient est en acidose respiratoire non compensée.
C) Le patient est en acidose métabolique non compensée.
D) Le patient est en acidose métabolique en cours de compensation.
E) Le patient est en alcalose métabolique en cours de compensation.
30) Soit le gaz du sang suivant : pH = 7,39, PaCO2 = 70 mmHg, [HCO3
-] = 40
mmol/L. On peut dire que :
A) Il peut s’agir d’une acidose respiratoire compensée.
B) Il peut s’agir d’une alcalose métabolique compensée.
C) Il peut s’agir d’une acidose métabolique non compensée.
D) Il peut s’agir d’une acidose respiratoire non compensée.
E) C’est un gaz du sang normal.
31) À propos de la respiration :
A) Elle se résume à l’étape ventilatoire.
B) La PaCO2 est inversement proportionnelle à la ventilation alvéolaire.
C) Une hypocapnie est une diminution anormale du pH artériel.
D) Au niveau de l’alvéole, l’entrée de l’oxygène dans le sang se fait
uniquement à l’inspiration.
E) Une hypoventilation entraine une hypercapnie.
32) Concernant les espèces en solution :
A) Un acide cède un proton selon Bronsted.
B) Une base forte est complètement déprotonée en solution.
C) La constante d’acidité Ka dépend de la concentration en ions
oxonium.
D) Un acide est d’autant plus fort que son pKa est grand.
E) L’ammoniaque NH3 est un exemple de base forte.
33) Concernant le titrage du chlorure d’ammonium NH4Cl 0,1 M par
l’hydroxyde de potassium KOH 0,01 M :
A) Le chlorure d’ammonium est un sel libérant en solution une base
faible.
B) A l’équivalence, le pH de la solution est égal à 7.
C) A l’équivalence, la dilution est prise en compte.
D) Au volume de demi-neutralisation, le pH de la solution est deux fois
plus important que le pKa.
E) Au volume de demi-neutralisation, une zone tampon est
identifiable.
 6
6
1
/
6
100%