Alcool primaire

L’essentiel sur la réaction chimique
1. Transformations en chimie organique
1.1. Modification de la chaîne carbonée d'une molécule
1.1.1. Fragmentation d'une chaîne carbonée
Le craquage catalytique
L'opération dite de craquage catalytique, brevetée par Eugène Houdry en 1928, permet de casser à l'aide d'un
catalyseur les grosses molécules d'hydrocarbures saturés à longues chaînes par l'agitation thermique. On obtient des
molécules plus petites à chaînes plus courtes, généralement des alcanes et des alcènes. Elle s'effectue à 500°C à
pression atmosphérique.
Le vapocraquage (ou hydrocraquage)
Il s’agit d’un craquage permettant d'obtenir des alcènes en présence de vapeur d'eau. Cette opération est effectuée
à 800°C et à pression atmosphérique.
1.1.2. Modification de la structure de la chaîne carbonée
Le reformage catalytique
Cette opération permet de modifier la structure d'une chaîne carbonée. Cette réaction s'effectue à température
et pression élevée.
L'isomérisation (ou ramification du squelette carboné)
Cette opération permet de transformer un alcane à chaine linéaire (hydrocarbure) en son isomère de constitution
ramifiée, à température modérée (120°C à 200°C).
Exemple :
La réaction d'isomérisation de l'octane
(IO = 0) en 2,2,4-triméthylpentane
(IO = 100)
La cyclisation
Elle consiste à transformer un alcane linéaire en cyclane (alcane à chaîne fermée ou cyclique) souvent ramifiés et en
dihydrogène dans des conditions voisines des précédentes. Cette transformation n'est possible que pour des alcanes
possédant au moins cinq atomes de carbone.
Exemples :
La réaction de cyclisation de l'hexane
En méthylcyclopentane
La déshydrocyclisation
Cette opération permet d'obtenir des dérivés benzéniques et du dihydrogène en réalisant la transformation
précédente à une température plus élevée (voisine de 500°C) et en présence d'un catalyseur (exemple le platine Pt).
Elle s'accompagne alors d'une déshydrogénation (élimination d'une molécule de dihydrogène) et conduit à
l'apparition d'un cycle benzénique.
Exemples :
Réaction de déshydrocyclisation
de l'hexane en benzène

1.1.3. Allongement de la chaîne carbonée
L'alkylation
Opération qui consiste à substituer (remplacer) un atome d'hydrogène d'une chaîne carbonée par un groupe alkyle.
On allonge la chaine d'un alcane en le faisant réagir avec un alcène (opération inverse du craquage). Son intérêt est
de produire des espèces chimiques à fort indice d'octane.
Exemple :
La réaction entre le méthylpropène et le méthylpropane
donne du 2,2,4-triméthylpentane
C4H8(g) + C4H10(g) C8H18(g)
La polymérisation par polyaddition (ajout de plusieurs molécules généralement identique)
Cette opération permet de rallonger la chaîne carbonée principale en réalisant une addition répétée d'un très grand
nombre de molécules insaturées appelées monomères. Elle conduit à une macromolécule appelée polymère.
Exemple : réaction de polymérisation de n molécules de monomère styrène
n est appelé indice (ou degré) de polymérisation et le groupe
—CH2—CH(Ph)— est appelé motif du polymère
1.2. Modification du groupe caractéristique
1.2.1. Espèces chimiques polyfonctionnelles
Définition :
Une espèce chimique est dite polyfonctionnelle si elle appartient à plusieurs classes fonctionnelles ou possède
plusieurs groupes caractéristiques identiques.
Groupe caractéristique
Fonction
Terminaison
Préfixe
Alcène
C C
-ène
Hydroxyle
OH
Alcool
-ol
hydroxy
Carbonyle
Aldéhyde
-al
formyl
Carbonyle
Cétone
-one
oxo
Carboxyle
Acide carboxylique
Acide -oïque
Ester
Ester
-oate de -yle
Amine
Amine
-amine
amino
Amide
Amide
-amide
Nitrile
‒ C N
Nitrile
-nitrile
cyano
H

Exemple :
OH
O
O
Acide 3-oxobutanoïque
1.2.2. Modification du groupe caractéristique
Une réaction chimique peut également modifier le groupe caractéristique de l'espèce chimique.
Exemple : réaction d'oxydation ménagée d’un alcool par les ions permanganate (1ère S)
R C O
H
H H
RC
HO
1.3. Les catégories de réaction en chimie organique
1.3.1. Substitution
Définition :
Une réaction de substitution est une réaction chimique au cours de laquelle un atome ou groupe d'atomes est
remplacé par un autre atome ou groupe d'atomes.
Exemple :
1.3.2. Addition
Définition :
Une réaction d’addition est une réaction chimique au cours de laquelle un atome ou un groupe d'atomes vient se
fixer sur des atomes initialement liés par une double ou une triple liaison.
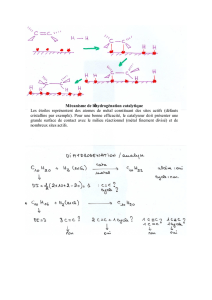
oxydation
ménagée
Alcool primaire
Aldéhyde
Oxydation ménagée
(oxydant en défaut)
Acide Carboxylique
Oxydation ménagée
(oxydant en excès)

Exemple :
1.3.3. Élimination
Définition :
Une réaction d’élimination est une réaction chimique au cours de laquelle deux atomes ou groupes d'atomes voisins
sont retirés d'une molécule. Entre les 2 atomes porteurs de ces groupes d'atomes se forme une double ou une triple
liaison.
Exemple :
1.4. Sites donneurs et accepteurs d’électrons
Sites donneurs
Définition :
Un site donneur de doublets d’électrons, site de forte densité électronique, peut être localisé sur un atome
possédant un doublet non liant ou entre deux atomes (doublet liant) ou sur un atome possédant une charge
partielle négative –.
Sites accepteurs
Définition :
Un site accepteur de doublets d’électrons, site de faible densité électronique, peut être localisé sur un atome
possédant une charge entière positive ou sur l’atome d’une liaison polarisée possédant une charge partielle
positive +.
Exemple :
1.5. Introduction aux mécanismes réactionnels
Définition :
Un mécanisme réactionnel décrit le déroulement, à l’échelle moléculaire, de chaque étape d’une transformation
chimique, en particulier la nature des liaisons rompues et formées, et l’ordre dans lequel se font ces ruptures et
ces formations.
2. Cinétique chimique
2.1. Classification des réactions

Réactions lentes : c'est une transformation dont l'évolution peut être suivie « à l'œil nu » ou avec les appareils
de mesure courants pendant quelques secondes (ou plus longtemps).
Réactions rapides : on dit qu'une transformation est rapide si elle se fait en une durée trop courte pour que son
évolution puisse être suivie « à l'œil nu » ou avec les appareils de mesure courants.
2.2. Facteurs cinétiques
2.2.1. La température
Une température plus élevée augmente l'agitation et donc la vitesse de réaction ;
Une température faible diminue le désordre et donc réduit la vitesse de réaction ;
Pour arrêter une réaction, on effectue une trempe dans le cas des solutions aqueuses qui consiste à plonger la
solution dans un mélange d'eau et de glace dont la température est proche de 0°C. Cela a pour effet de stopper
la réaction.
2.2.2. La concentration
Plus les concentrations sont élevées, plus la chance d'obtenir des chocs efficaces est forte. Donc une augmentation
de la concentration accélère la vitesse d’une réaction chimique.
2.3. Catalyse
Un catalyseur est une espèce chimique qui va servir d'intermédiaire pour accélérer la réaction mais qui n’apparaît
pas dans l’équation de cette réaction. Lorsqu’un catalyseur est utilisé pour accélérer une transformation, on dit que
celle-ci est catalysée.
On distingue trois types de catalyseurs :
- Les catalyseurs homogènes : réactifs et catalyseurs sont réunis en une seule phase ;
- Les catalyseurs hétérogènes : le catalyseur et les réactifs se trouvent dans deux phases différentes ;
- Les catalyseurs enzymatiques : le catalyseur est une enzyme, c'est-à-dire une protéine élaborée par les
systèmes vivants. Il s'agit à la fois d'une catalyse homogène car le catalyseur et les réactifs du milieu
biologique ne forment qu'une seule phase aqueuse, et d'une catalyse hétérogène du fait du mode d'action
(présence d'un site actif).
Remarques :
- Un catalyseur n'apparait jamais dans l'équation globale de la réaction car il est utilisé puis régénéré ;
- Un catalyseur modifie le mécanisme réactionnel de la réaction étudiée, mais ne modifie pas le sens
d’évolution d’un système, ni son état d’équilibre ;
- Un catalyseur influe uniquement sur la cinétique de la réaction chimique considérée ;
- En général, un catalyseur est spécifique d’un type de réaction ;
- Un catalyseur peut également être sélectif (voir fiche « l’essentiel sur les molécules », §4.6).
2.3. Suivi temporel d’une réaction chimique
2.3.1. Temps de demi-réaction
Définition :
Le temps de demi-réaction, noté t½, est la durée nécessaire pour que l'avancement x de la réaction soit égal à la
moitié de sa valeur finale.
x(t½) = ½ xfinal
Remarques :
- Si la transformation est totale, ce qui correspond à la disparition du(des) réactif(s) limitant(s), l'avancement
final est égal à l'avancement maximal :
x(t½) = ½ xmax
 6
6
1
/
6
100%