Correction du DS - Cinétique et catalyse

Page 1 sur 2
On considère la réaction de décomposition d’un colorant vert A par les ions hypochlorite ClO – en une espèce B incolore.
Les ions hypochlorite ClO – sont introduits en excès. L’équation de la réaction s’écrit :
)(
)(
)(
)( 2aq
aq
aq
aq BClAClO
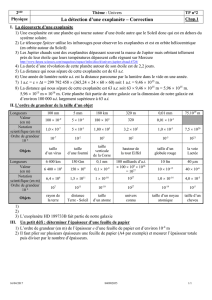
En suivant l’évolution du milieu réactionnel on peut tracer la courbe suivante :
1. La concentration C1 représente-t-elle la concentration de l’espèce A ou de l’espèce B ? Justifier. ❷
Il s’agit de la concentration de l’espèce A car sa quantité de matière diminue au cours de la réaction.
B est un produit de la réaction, sa quantité augmente.
2. Le volume du milieu réactionnel est de V = 250 mL. Déterminer la quantité de matière initiale n1 de A. ❶
C1 = n1/V donc n1 = C1.V = 0,2.10-3 x 250.10-3 = 5.10-5 mol
3. Quel est le réactif limitant de cette réaction ? Justifier. ❶
C’est le réactif A car les ions hypochlorites sont introduits en excès.
4. Le tableau d’avancement de la réaction a été dressé ci-dessous.
Compléter la 1ère, 2ème et 4ème ligne du tableau (état initial, intermédiaire et maximal) ❸ voir tableau
5. Définir le temps de demi-réaction. ❶ Durée au bout de laquelle l’avancement x = xmax/2
6. Déterminer le temps de demi-réaction de cette transformation. L’exprimer en min et le convertir en s. ❷
Lorsque la moitié du réactif A s’est transformé, on a atteint le temps de demi-réaction.
Cela correspond à une concentration C1 = C1,initiale/2 = 0,2/2 = 0,1.10-3 mol/L
Soit t1/2 = 10 min = 600 s (voir en rouge sur le graphique)
L’expérimentateur considère la réaction comme terminée lorsque l’avancement final atteint 95% de l’avancement
maximal.
7. En déduire l’état final du système en complétant le tableau d’avancement. ❷ voir tableau
8. Quelle est la valeur de la concentration C1 à l’état final ? ❶
A l’état final, il reste une quantité de matière n1,f = 0,25.10-5 mol de réactif A.
Déterminons C1,f = n1,f / V = 0,25.10-5 / 250.10-3 = 1.10-5 = 0,01.10-3 mol/L
9. En déduire la durée de la réaction tf à l’aide du graphique. ❶ Voir en vert sur la courbe : tf = 35 min
NOM Prénom : Classe : TS Durée : 1h
Appréciation :
CORRECTION
/20
DS – Cinétique chimique Date :
35
1
0
2
0
3
0
4
0
5
0
0,2
0,1
0,0
0
C
1
(10
-3
mol∙L
-1
)
t (min)

Page 2 sur 2
10. Quelle technique expérimentale a-t-on utilisé pour réaliser le suivi de cette réaction ? Justifier.
Préciser la grandeur physique mesurée au cours du temps et le nom de l’appareil. ❷
On utilise la spectrophotométrie car l’espèce A est colorée, on s’attend donc à avoir une diminution de l’absorbance au
cours du temps (les autres espèces chimiques étant incolores).
L’appareil utilisé est le spectrophotomètre.
11. Expliquer comment a été obtenu ce graphique à partir des valeurs mesurées. (calculs, loi utilisée) ❷
D’après la loi de Beer-Lambert A = k.C1 donc C1= A/k
Ainsi si on connait la mesure de A à n’importe quel instant, on peut en déduire la concentration de l’espèce A à ce
même instant. Et on peut obtenir l’évolution de la concentration de A au cours du temps.
12. L’expérimentateur trouve la réaction trop lente et aimerait la rendre plus rapide. Que peut-il faire ?
Citer au moins 4 façons différentes de résoudre son problème. ❷
Il peut chauffer le milieu réactionnel car on sait que la température est un facteur cinétique.
Il a aussi la possibilité d’augmenter la concentration des réactifs.
Un choix judicieux du solvant pourrait peut-être accélérer cette réaction.
Enfin, s’il trouve un catalyseur adapté à cette transformation, il peut diminuer le temps de réaction.
Exprimé en mol ClO- (aq) + A (aq)
Cl- (aq) + 2 B(aq)
Etat initial
x = 0 excès 5.10-5 0 0
Etat intermédiaire
x excès 5.10-5 - x x 2x
Etat final
xf = 4,75.10-5 excès 0,25.10-5 4,75.10-5 9,5.10-5
Etat maximal
xmax = 5.10-5 excès 0 5.10-5 10.10-5
1
/
2
100%