TP4.Etude des spectres - SCY-PHY

TP4.Quel spectre caracterise la lumiere emise ou absorbee par une entite chimique ?
I.Fraunhofer et le spectre du Soleil
Le rayonnement émis par les étoiles est en première approximation assimilable au rayonnement d’un corps à
température élevée.
1) Sans lire le texte, à votre avis, comment sera le spectre de la lumière solaire observée de la Terre ?
Document 1 : Extrait de « L’astronomie » de Michel MARCEUN ; Éd. Hachette.
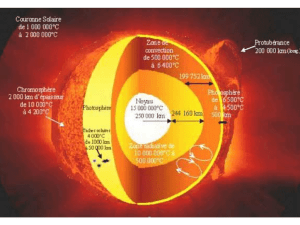
« Comme toute étoile, le Soleil est une énorme sphère de gaz très chaud qui
produit de la lumière. […] La photosphère (surface du Soleil), bien observable en
lumière visible, est à une température d’environ 5500°C.
Si le Soleil était sans atmosphère, le spectre de la lumière émise serait continu.
En 1814, le physicien allemand J. FRAUNHOFER remarque dans le spectre du
Soleil une multitude de raies noires
.
L’existence de ces
raies d’absorption
est due à la présence d’une atmosphère
autour du Soleil, appelée
chromosphère
, et s’étendant sur 2000 km d’épaisseur
environ.
Les atomes présents dans cette chromosphère « interceptent » leurs radiations
caractéristiques qui seront donc absentes du spectre vu depuis la Terre.
Entre 300 nm et 700 nm, il existe plus de 20000 raies répertoriées.
Cette atmosphère est constituée de gaz sous faible pression.
L’analyse spectrale permet de connaître la composition chimique détaillée et
précise du Soleil. Tous les éléments connus sur Terre y sont présents, certains à l’état de trace.
En fraction de masse, les deux éléments les plus abondants sont l’hydrogène (78,4 %), l’hélium (19,6 %) et 2%
d’autres éléments. »
Document 2 :
Les radiations les plus intenses produites par le Soleil ont une longueur d’onde λ = 582 nm.
2) Quelle(s) zone(s) doit franchir la lumière du Soleil avant d’arriver sur Terre ?
3) Quelle découverte Fraunhofer a-t-il faite en 1814 ?
4) Expliquer pourquoi l’atmosphère du Soleil empêche d’observer un spectre continu.
5) Pourquoi l’analyse des raies sombres du spectre du Soleil permet-elle d’en déduire la composition de sa
chromosphère ?
2. Analyse de spectres
Chaque radiation émise ou absorbée par une entité chimique est repérée par un nombre équivalent à une longueur, la
longueur d’onde, notée λ (prononcer lambda).
Spectre d’émission de la lumière blanche
Spectre de raies d’émission du sodium Na
Absorption de la lumière par une solution jaune
Absorption de la lumière par une vapeur d’atomes de
Na
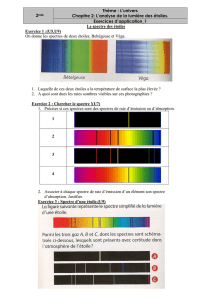
a) Quel type de spectres est émis par un corps chauffé (une étoile peut être) ?
Complète la première case du tableau en coloriant le spectre de la lumière blanche.
température moyenne de surface de l’étoile (C)
3OOO
8OOO
10000
couleur
Rouge orangé
blanche
bleue
exemples
Bételgeuse
Sirius
Rigel
Spect
re
Absorption de lumière par
l’atmosphère du Soleil

b) Par contre, la lumière, émise par une lampe à vapeur de sodium, donne un spectre comportant principalement
une double raie de longueur d’onde λ = 589 nm:
Quelle est la couleur de cette raie ?
Complète la case d’à-côté (sur fond noir).Aidez-vous avec le livre page 29
c) En traversant certains milieux (vapeurs ou liquides), la lumière blanche est en partie absorbée.
Modifie le spectre de lu lumière blanche après la traversée d’un liquide, une solution jaune.
Etude de la décomposition avec un spectroscope à réseau.
1. Etude de quelques spectres.
Expérience 1.
A l'aide d'un spectroscope à réseau, réaliser le spectre de la lumière du soleil.
Décrire et faire un schéma de ce spectre.
Expérience 2.
A l'aide d'un spectroscope à réseau, réaliser le spectre des lampes de la salle.
Faire un schéma de ce spectre.
Expérience 3.
A l'aide d'un spectroscope à réseau et de votre système de lampe, réaliser le spectre d'une lumière rouge, d'une
lumière verte.
Faire un schéma de chaque spectre.
Conclusion 1.
Parmi les spectres réalisés, il y a des spectres d'émission continu et des spectres d'émission de raies.
Classer les spectres étudiés selon les 2 classifications données.
Donner une définition de ses 2 types de spectres.
2. Etude d'une lampe spectrale.
Quelle est la couleur de la lampe spectrale à vapeur de sodium (bureau ) ?
A l'aide d'un spectroscope à réseau, réaliser le spectre de cette lampe spectrale.
Faire un schéma de ce spectre.
Sachant que la lampe ne contient que de la vapeur monoatomique, quelle est l'utilité d'un spectre d'émission ?
Faire de même avec la lampe spectrale à magnesium.
3. Les spectres d'absorptions.
Au bureau, réaliser le spectre d’absorption (car on étudie la lumière après avoir traversé une solution)
du sulfate de cuivre en réalisant l’expérience suivante :
Faire un schéma de ce spectre.
Réaliser le spectre d'absorption de la solution de sulfate de cuivre avec le spectrophotomètre.
Faire un schéma de ce spectre.
Quelle est la couleur de la solution de sulfate de cuivre ?
Quel est l'ion responsable de cette couleur ?
Comparer le spectre au spectre d'émission réel donné par l'ordinateur pour l’élément cuivre.
A partir des réponses précédentes, peut-on expliquer le spectre obtenu ?
Conclusion : Une entité chimique (atome ou _______ ) ne peut ___________________ que les radiations qu’il
est capable d’émettre.
A chaque ________ noire d’absorption d’un spectre d’une étoile correspond donc la trace d’un ____________
chimique capable d’émettre une ___________ de même longueur d’onde.
Lampe
1
/
2
100%