des informations complémentaires sur cette présentation

Journée "Iodes", Paris, février 2002
Etude par microscopie ionique analytique des profils de distribution thyroïdienne de
l’iode chez des rats nés de mères déficientes en iode 127 et contaminés par l’iode 129
à des âges variant de 1 à 21 jours
J.R. Jourdain, Institut de Protection et de Sûreté Nucléaire
L’accident du 26 avril 1986 survenu à la centrale nucléaire de Tchernobyl, localisée en
Ukraine à environ 20 km au sud de la frontière avec la Biélorussie, est à l’heure actuelle
l’événement le plus grave qu’ait connu l’industrie nucléaire. Cet accident a conduit en 1986 à
l’évacuation d’environ 116000 personnes des régions avoisinantes du réacteur et au
déplacement après 1986 d’environ 220000 habitants d’Ukraine, de Biélorussie et de Russie.
Parmi les isotopes ingérés et/ou inhalés par la population, l’iode 131, dont la quantité
relarguée depuis le réacteur est estimée à environ 1760 PBq, est le principal élément incriminé
dans les doses reçues à la thyroïde.
Concernant les pathologies observées dans les années suivant l’accident chez les
personnes exposées, les dysfonctionnements thyroïdiens développés par les enfants
constituent un sujet de préoccupation majeure du corps médical. Ainsi, d’après les données du
rapport 2000 de l’UNSCEAR [1], le nombre de cas de cancers de la thyroïde observés en
Biélorussie et en Ukraine chez les sujets nés avant la catastrophe et âgés de moins de 15 ans
au moment du diagnostic, est passé contre toute attente de 109 pour la période 1986-1990 à
576 pour la période 1991-1995. En Biélorussie, le nombre de cancers thyroïdiens touchant les
enfants exposés avant l’âge de 4 ans n’a pas cessé d’augmenter entre 1986 et 1997 et semble
décroître depuis 1995 dans la tranche d’âge de 5 à 9 ans au moment de l’accident.
Parmi les paramètres qui seraient impliqués dans cette augmentation de cancers
figurent l’âge au moment de l’exposition ainsi que la déficience iodée dont souffraient les
populations touchées. Plusieurs équipes se sont également interrogées sur le rôle des isotopes
à vie courte de l’iode (nombre de masses compris entre 132 et 135) par rapport à celui de
l’iode 131 quant à la distribution géographique des cancers thyroïdiens de l’enfant.
Afin de déterminer le rôle de chacun de ces facteurs, une collaboration a été initiée en
2000 entre le laboratoire de biophysique de la Faculté de médecine Xavier Bichat et le
laboratoire d’évaluation et de modélisation de la dose interne de l’Institut de Protection et de
Sûreté Nucléaire. Les travaux entrepris visent à établir les profils de distribution cellulaire des
isotopes 127 et 129 de l’iode au sein de thyroïdes prélevées chez des rats nés de mères
déficientes en iode et contaminés par l’iode 129 dans un délai variant de 24 heures (nouveau-
nés) à 21 jours (adolescents) après la naissance. Parmi les techniques d’analyse élémentaire, la
microscopie ionique analytique ou SIMS (Secondary Ion Mass Spectrometry) [2] a été choisie
pour mener à bien cette étude. En effet, cet outil permet non seulement de visualiser
directement l’iode au niveau des cellules mais également d’en différencier les isotopes. L’idée
de base est d’appliquer les principes de la spectrométrie de masse à l’analyse de surface d’un
échantillon solide. Ce dernier est bombardé sous vide par un faisceau d’ions primaires de
quelques keV et sous l’effet de ce bombardement, les atomes de la surface de l’échantillon
ayant reçu une énergie suffisante sont progressivement pulvérisés, notamment sous forme
d’ions représentatifs de la composition élémentaire de la matrice d’où ils ont été émis. Ils sont
ensuite accélérés, collectés et focalisés en un faisceau transportant l’image de tous les ions
émis par la surface pulvérisée. Celui-ci est ensuite analysé au moyen d’un spectromètre de
masse et séparé en autant de faisceaux qu’il y a d’ions d’une masse et d’une charge données
au sein du faisceau initial. Le faisceau sélectionné est ensuite dirigé vers un système de

détection permettant de visualiser la distribution de l’ion étudié au sein de la structure
biologique analysée.
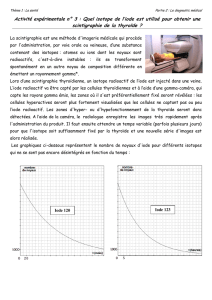
Les acquisitions réalisées aux masses 127 et 129 de l’iode sur les thyroïdes exposées
permettront d’étudier l’influence de l’âge de la contamination et du déficit alimentaire en
iode, les groupes témoins étant constitués de rats nés de mères normoiodées. Par ailleurs, les
calculs des rapports isotopiques iode 127/iode 129 seront exploités afin d’évaluer les doses
reçues à la thyroïde tout en tenant compte d’une éventuelle hétérogénéité de distribution.
Enfin, l’étude des profils de distribution à des temps correspondants aux périodes physiques
des isotopes à vie courte de l’iode permettra de déterminer la contribution de l’incorporation
de ceux-ci à la dose absorbée en fonction de l’âge de la contamination.
[1] United Nations Scientific Committee on the Effects of Atomic Radiation. Sources and
effects of ionizing radiation, Volume II, Annex J, United Nations, New York, 2000.
[2] Slodzian G. Etude d’une méthode d’analyse locale chimique et isotopique utilisant
l’émission ionique secondaire. Thèse de Doctorat ès Sciences Physiques, Paris, 1963.
1
/
2
100%