cours5T-spectre-visb.. - fabrice CAPBERT Sciences Physiques

Cours n°5 « Spectroscopie UV-visible et IR » Page 1
Les compétences à acquérir…
- Associer un groupe caractéristique à une fonction dans le cas des alcool, aldéhyde,
cétone, acide carboxylique, ester, amine, amide.
- Connaître les règles de nomenclature de ces composés ainsi que celles des alcanes et
des alcènes.
- Exploiter un spectre IR pour déterminer des groupes caractéristiques à l’aide de
tables de données ou de logiciels.
- Mettre en œuvre un protocole expérimental pour caractériser une espèce colorée.
- Exploiter des spectres UV-visible.
I Les familles en chimie organique : Voir fiche famille et groupes caractéristiques
II- Comment les chimistes utilisent les ondes pour caractériser des atomes, des molécules ?
Après avoir isolé un corps pur d’un mélange naturel ou synthétique, le chimiste possède plusieurs techniques
pour l’analyser.
Les méthodes physiques sont des méthodes rapides qui nécessitent peu de matière. En contrepartie, elles
utilisent un matériel sophistiqué et généralement couteux. Ce sont essentiellement des méthodes
spectroscopiques.
La spectroscopie d’absorption est l’étude des interactions entre des OEM et la matière. L’absorption d’OEM
par une molécule introduit des « modifications » très rapides de la molécule (le terme exact est transition) et
différentes selon la longueur d’onde de l’onde.
On distingue :
- La Spectroscopie moléculaire : infrarouge-Visible-Ultraviolet permettant de déterminer les
……………………………………………………………………………….
- La Spectroscopie RMN (résonance magnétique nucléaire) qui permet de localiser les hydrogènes
(Grâce à leur moment magnétique de spin nucléaire), c'est-à-dire la structure du ………………………………….
1- Spectroscopie d’absorption UV-visible:
a- Le principe :
Lorsque la lumière traverse une solution, elle est en partie absorbée et en partie transmise. Cette
absorption d’énergie dans l’UV-visible correspond à une transition électronique, c’est-à-dire au passage
d’un électron d’un niveau d’énergie plus faible à un niveau plus élevé.
Lycée Joliot Curie à 7
PHYSIQUE - Chapitre V
Classe de Ter S
Cours n°5 « Spectroscopie UV-visible et IR »

Cours n°5 « Spectroscopie UV-visible et IR » Page 2
b- Spectre UV-visible :
Le spectrophotomètre mesure l'absorbance A (grandeur sans unité) qui se
définit par :
Elle est comprise entre 0 (pas d’absorption : solution incolore) et l’infini
(absorption totale : solution noire).
Remarque : Le rapport T= I/I0 est appelé ………………………………………………
Cette absorbance est liée à la concentration
c
d’une solution qui ne contient qu’une seule espèce, par la loi de
Beer Lambert : A = k.c
Dans le détail, la constante k dépend : L’absorbance s’écrit
- …………………………………………………
- ………………………………………………………,
- …………………………………………………
avec coefficient d'absorption molaire qui dépend du solvant de la température et de la longueur d'onde
unité de
Remarque :si la solution contient n espèces A =
2- Spectroscopie d’absorption infrarouge
a- Principe
La spectroscopie infrarouge (IR) est dans son principe identique à la spectroscopie UV-visible. Le domaine de
longueur d'onde utilisé est (2500 nm - 25000 nm). Les OEM (onde électromagnétique) interagissent avec les
liaisons covalentes de la molécule (leur mode de vibration). Pour cette raison la spectroscopie IR permet de
repérer ………………………………………………………………… et d'en déduire les groupes caractéristiques présents dans la
molécule.
c- Interprétation d’un spectre IR :
En ordonnée figure la
transmittance
Une transmittance de 100 %
signifie qu’il n’y a pas
d’absorption
Lorsqu’il y a absorption la
transmittance diminue. C’est
la raison pour laquelle les
bandes d’absorption pointent
vers le bas.
En abscisse, La grandeur
représentée en abscisses
est le nombre d’ondes qui
est l’inverse de la longueur
d’onde :
L’intéraction d’une liaison avec le rayonnement OEM se traduit par une …………………………………………………
caractéristique sur le spectre.

Cours n°5 « Spectroscopie UV-visible et IR » Page 3
On distingue deux domaines sur un spectre :
La région pour faibles valeurs de ( <1500 cm-1), qui est caractéristique du composé et des fonctions
présentes est appelée "empreinte digitale". Dans cette zone, il est en général difficile d’attribuer les pics
observés à des groupes d’atomes. Cette zone permettra de comparer le spectre avec un ou des spectres de
référence.
La région qui correspond aux grandes valeurs de (4000-1500 cm-1) où apparaissent les bandes
caractéristiques de certaines liaisons, par exemple C=O, C=C, C-H, O-H, N-H…qui permet l’identification de
groupes caractéristiques. Dans cette zone chaque bande d’absorption dont le nombre d’onde se trouve dans les
plages ci-dessous et dans des tables de référence est caractéritique d’un type de liaison chimique.
liaison
nombre d'onde (cm-1)
intensité
O-H libre
3580 à 3650
F, fine
O-H lié
3200 à 3400
F, large
N-H
3100 à 3500
M
Ctri-H (carbone trigonal)
3000 à 3100
M
Ctet-H (carbone tétragonal)
2800 à 3000
F
C=Oester
1700 à 1740
F
C=C
1625 à 1685
F
C=Oacide
1680 à 1710
F
C=O amide
1650-1700
F
Ctet-H
1415 à 1470
F
C-O
1050 à 1450
F
C-C
1000-1250
F
C-N
1020-1220
m
Pour déterminer les groupes caractéristiques il faut :
en utilisant cette figure repérer les liaisons chimiques grâce à leurs nombres d’onde,
rechercher les ………………………………………………… possédant ces liaisons.
Comme certaines liaisons appartiennent à plusieurs groupes, il faut en utilisant les tables :
vérifier que toutes les bandes caractéristiques des …………………… retenus sont présentes sur le spectre,
utiliser les valeurs précises des nombres d’onde pour départager 2 groupes.
Cas particulier de la liaison hydrogène :
Lorsqu'il y a présence de liaisons hydrogène, l'allure du spectre est
modifiée. En effet, on observe dans ce cas une bande très large et de
très forte absorption autour de 3300 cm-1.
Pour un alcool très dilué, en phase gazeuse par exemple, la bande
d'absorption due à la liaison OH est fine et se situe vers 3600 cm-1.
En phase plus condensée (liquide par exemple), il existe des liaisons
hydrogène entre les molécules d'alcool et cette bande est recouverte
par la bande large due à la liaison hydrogène.
…………………………………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………
Exemple du spectre de l'hexan-1-ol :
- courbe 1 : alcool pur avec présence de
liaison hydrogène bande large entre 3200 et
3400 cm-1
- courbe 2 : alcool dans un solvant
défavorisant les liaisons hydrogène bande fine
entre 3590 et 3650 cm-1
Schéma d'une liaison hydrogène entre
deux molécules d'eau.

Cours n°5 « Spectroscopie UV-visible et IR » Page 4
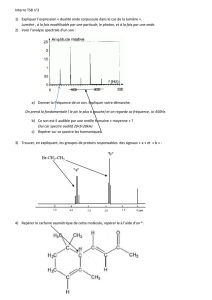
Exemple: Le spectre infrarouge d’une espèce moléculaire est donné ci-dessous :
En se reportant à la table IR fournie ou à la table de données du livre, déterminez si cette espèce peut contenir
les groupes ou liaisons : C=O, N-H, N-H2, C-C, C=C, C-N, Ctet-H.
Remarque : on notera les atomes de carbone Ctet pour un carbone tétraédrique (4 liaisons simples), Ctri pour un
carbone trigonal (1 liaison double), et Cdi pour un carbone digonal (1 liaison triple ou deux liaisons doubles).
Cette molécule peut-elle être : le propène, le propane, le propanamide, le N-méthyléthanamide ? Justifier.
1
/
4
100%