Galéniste

UE 8 - Notions de base 1
Viviane ANTONIETTI
PACES

PA
Recherche
exploratoire
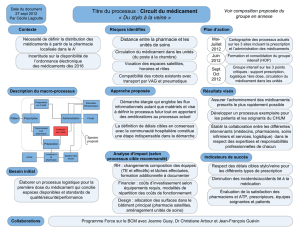
Conception d’un médicament
Développement
galénique
Recherche et développement
Développement
industriel
–Extraction
–Synthèse
–Biotechnologie
Commercialisation
Recherche
Biopharmaceutique
du devenir P.A.
20 ans
1 à 3 ans
I II III
2
100 000 100 10 1 ou 2
8 à 10 ans
Essais
préclinique Production
AMM/CTD
Essais
cliniques
Expiration
du brevet
IV
10 à 11 ans
1
Galénique
d’innovation
Procédure
d’enregistrement
Princeps
autorisation délivrée par l’ANSM

Procédures d’AMM
Qualité
Efficacité
Sécurité
Rapport
Bénéfice
Risque
Dossier
CTD
Origine et nature des matières
premières, procédés de
synthèses et de fabrication,
stabilité du produit fini, …
Basé sur les résultats
des essais précliniques
et cliniques
3

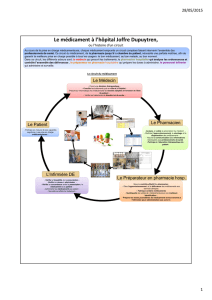
AMM
AMM nationales
•autorisation délivrée par l’Agence nationale de
sécurité du médicament et des produits de santé
(ANSM) pour la France
AMM procédures Européennes
−Centralisée
−Reconnaissance mutuelle
•obligatoire depuis 1998 pour tout médicament ayant
déjà une AMM et qui est destiné à être mis sur le
marché dans plus d’un État membre
−Décentralisé
4

Durée et renouvellement des AMM
Autorisations délivrées pour une durée
de 5 ans, renouvelées sans limitation de
durée
–sauf nécessité de réévaluation du rapport
bénéfice/risque pour un renouvellement
supplémentaire sur la base d’une
réévaluation des effets thérapeutiques au
regard des risques
5
 6
6
 7
7
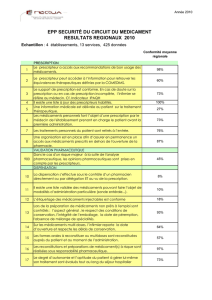
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%