Dépistage de l`hypothyroïdie néonatale à Dakar : à propos de 522
publicité

UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
,
,
FACULTE DE MEDECINE DE PHARMACIE ET D'ODONTO-STOMATOLOGIE
ANNEE 1999
DEPISTAGE DE L'HYPOTHYROïDIE
NEONATALE A DAKAR: A PROPOS
DE 522 NOUVEAU-NES DU CENTRE
HOSPITALIER ABASS NDAO
-
'
THE8E
Pour obtenir le Grade de DOCTEUR EN PHARMACIE
(DIPLOME D'ETAT)
Présentée et soutenue publiquement le 23 Juin 1999
par
Georges ANANIAS MANSALY
Né le 24 Février 1967 El Vélingara (Sénégal)
MEMBRES DU JURY
Président:
M.
José Marie AFOUTOU
Professeur
Membres:
M.
MamadOlf BADIANE
Maître de Conférences Agrégé
M.
Pape Amadou DIOP
Maître de Conférences Agrégé
Mme
Sylvie SECK GASSAMA
Maître de Conférences Agrégé
Mme
Sylvie SECK GASSAMA
Maître de Conférences Âgrégé
Directeur de Thèse:
UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
FACULTE DE MEDECINE, DE PHARMACIE ET D'ODONTOLOGIE
PERSONNEL DE LA FACULTE
Doyen ---------------------------- M. René
NDOYE
Premier Assesseur ----------------- --------- M. Mamadou
BADIANE
Deuxième Assesseur --------- . - -
MOREIRA DIOP
---------- Mme Thérèse
Chef des services adminislratifs-------------------- M. Assane
.'
CISSE
I-MEDECINE
LISTE
DU
PERSONNEL
ENSEIGNANT
PAR
GRADE
POUR
L'ANNEE
UNIVERSITAIRE 1998-1999
PROFESSEURS TITULAIRES
M. José Marie
AFOUTOU
Histologie Embryologie
M. Mamadou
Ba
Pédiatrie
M. Serigne Abdou
Ba
Cardiologie
M. Sai if
BADIANE
Maladies Infectieuses
M. Fallou
CISSE
Physiologie
M. Fadel
DIADHIOU
Gynécologie/Obstétrique
M. Baye Assane
DIAGNE
Urologie
M. Lamine
DIAKHATE
Hématologie
DIALLO
Parasitologie
DIOP
ORL
Mme Thérèse Moraira
DIOP
Médecine interne 1
M. Sémou
DIOUF
Cardiologie
M. Mohamadou
FALL
Pédiatrie
M. Mamadou
GUEYE
Neuro-Chirurgie
M. Momar
GUEYE
Psychiatrie
M. Nicolas
KUAKUVI
Pédiatrie
M. Bassirou
NDIAYE
Dermatologie
M. Ibrahima Pierre
NDlAYE
Neurologie
NDIA'Œ.
Ophtalmologie
M. Samba
-
M. El Hadji
...
• M. Madoune Robert
M. Mouhamadou
.NDIAYE
SbiCU'llie Thoracique et
Cardiovasculaire
•
M. Mouhamadou MI'0sour
NDIA'Œ
M. Papa Demba
NOIAYE·
Anatomie P athol<>gie
M. Mamadou
NDOYE
Chirurgie infantile
M. René
NDOYE
Biophysique
M. Abibou
SAMB
Bactériologie - Virologie
M. Mamadou
SARR
Pédiatrie
.---Heurologie
SECK
Maladies Infectieuses
M. Seydina Issa Laye
SEYE
OrthopédiefTraumatologie
M. Dédéou
SIMAGA
Chirurgie générale
M. Abdourahmane
SOW
Médecine préventive
M. Housseyn Dembel
SOW
Médecine légale
M. Mamadou Lamine
SOW
Pédiatre
M. Moussa Lamine
SOW
Médecine légale
M. Cheikh Tidiane
TOURE
Chirurgie générale
M. Pape
TOURE
Cancérologie
M. Alassane
WADE
Ophtalmologie
MmeAwa
COLL
MA/TRES DE CONFERENCES AGREGES
M. Mamadou
BA
Urologie
M. Moussa
BADIANE
Radiologie
M. Seydou Boubacar
-
BADIANE
Neure-Chirurgie
M. Mohamed Diawo
BAH
Gynécologie/Obstétrique
M. Moussa Fafa
CISSE
BactériologieNirologie
M. Addarallmane
DIA
Anatomie
M. Amadou Gallo
DIOP
Neurologie
M. El Hadj Ibrahima
DIOP
Orthopédie-Traumatologie
M. Saïd Norou
DIOP
Médecine interne Il
M. Raymond
DIOUF
OR.L.
M. Sauvasin
DIOUF
OrthopédiefTraumatologie
M. Babacar
FALL
Chirurgie Générale
M.lbrahima
FALL
Chirurgie Pédiatrique
Mme MameAwa
FAYE
Maladies infectieuses
Mme Sylvie SECK
GASSAMA
Biophysique
M.Oumar
GAYE
Parasitologie
M. Serigne Maguéye
GUEYE
Urologie
M. Abdoul Almamy
HANE
Pneumo-phtisiologie
M. Salvy Léandre
MARTIN
Pédiatrie
M. Victorino
MENDES
Anatomie pathologie
M. Jean Charles
MOREAU
Gynécologie
Mme Mbayang
NDIAYE 1 NIANG
Physiologie
M. Mohamed Fadel
NDIAYE
Médecine interne
M. Papa Amadou
NDIAYE
(Clinique médicale 1)
M. Youssoupha
SAKHO
Neuro- Chirurgie
M. Niama DIOP
SALL
Biochimie médicale
Mme Bineta
SALL 1 KA
Anesthésiologie-
Réanimation
M. Mohamadou Guélaye
SALL
Pédiatrie
M. Moustapha
SARR
Cardiologie
M. Birama
SECK
Pédopsychiatrie
M. Pape Sali!
SOW
Maladies infectieuses
Mme Haby
SIGNATE 1SY
Pédiatrie
M. Omar
SYLLA
Psychiatrie
M. Doudou
THIAM
Hématologie
M. Meissa
TOURE
Biochimie médicale
CHARGES D'ENSEIGNEMENT
* * *
M. Claude
MOREl RA
Pédiatrie
MAITRES-ASSISTANTS
M. El Hadj Amadou
BA
Ophtalmologie
M. Boubacar
CAMARA
Pédiatrie
M. El Hadj Souleymane
CAMARA
OrthopédielTraumatologie
M. Jean-Marie
DANGOU
Anatomie Pathologie
M. Michel
DEVELOUX
Dermatologie
M.lbrahima
DIAGNE
Pédiatrie
M. Massar
DIAGNE
Neurologie
M. Djibril
DIALLO
Gynécologie/Obstétrique
M. Bernard Marcel
DIOP
Maladies Infectieuses
M. Ibrahima Bara
DIOP
Cardiologie
M. Alassane
DIOUF
Gynécologie/Obstétrrque
M. 80ucar
DIOUF
Médecine Interne 1
M. Mamadou Lamine
DIOUF
Médecine Interne 1
M. Saliou
DIOUF
Pédiatrie
M.Oumar
FAYF.
Parasitoloqie
Mme Giséle
WOTQ/ FAYE
Anatomie pathologie
M. Abdoul
KANE
Cardiologie
M. Assane
KANE
Dermatologie
M. Abdoulaye
NDIAYE
Anatomie/Chirurgie
M. Adama Bandiougou
NDIAYE
Immunologie (Hématologie)
Mme Coura SEYE
NDIAYE
Ophtalmologie
M. Issa
NDIAYE
O.RL
M. El Hadj
NIANG
Radiologie
M. Abdoulaye
SAMB
Physiologie
M Doudou
SARR
Psychiatrie
M. Amadou Makhar
SECK
Psychiatrie
M. Gora
SECK
Physiologie
M. Ahmed Iyane
SOW
BactériologieNirologie
Mme Hassanatou
TOURE/SOW
Biophysique
M. Mouhamadou Habib
SY
Orthopédieffraumatologie
M. Cheickna
SYLLA
Urologie
M. Alé
THIAM
Neurologie
ASSISTANTS DE FA CUL TE - ASSITANTS
DES SERVICES UNIVERSITAIRES DES HOPITAUX
* * *
M. Boubacar Samba
DANKOKO
Médecine préventive
M. Abdoulaye Séga
DIALLO
Histologie/Embryologie
M. Yémou
DIENG
Parasitologie
M. Dialo
DIOP
BactériologieNirologie
M. Mamadou
DIOP
Anatomie
M. Moctar
DIOP
Histologie/Embryologie
M. Saliou
DIOP
Hématologie
Mme Mame Coumba GAYE
FAYE
Médecine légale
Mme Khadissatou SECK
FALL
Hématologie
M. Oumar
FAYE
Histologie/Embryologie
Mme Arame MBENGUE
GAYE
Physiologie
M. Lamine
GUEYE
Physiologie
M. El Hadj Alioune
Lü
Anatomie
M.lsmaïla
MBAYE
Médecine légale
M. Mamadou
MBODJ
Biophysique
M.Oumar
NDOYE
Biophysique
M. Ndéné Gaston
SARR
Biochimie médicale
Mme Anla
TALLI DIA
Médecine préventive
Mlle Awa Oumar
TOURE
Hématologie
M. Kamadore
TOURE
Médecine préventive
M. Issa
WONE
Médecine préventive
CHEFS DE CLINIQUE - ASSISTANTS
DES SERVICES UNIVERSITAIRES DES
HOPITAUX
Mme Marième
BA / GUEYE
Gynécologie/Obstétrique
M. Momar Codé
BA
Neuro~
M Cheikh Ahmed Tidlane
CISSE
Gynécologie/Obstétrique
Mme Mariama Safiélou
CISSE / KA
Médecine interne Il
M. André Vaubert
DANSOKHO
OrthopédiefTraumatologie
Mme Elisabeth FELLER
DANSOKHO
Maladies infectieuses
M. Ahmadou
DEM
Cancérologie
M. Marne Thierno
DIENG
Dermatologie
M. Rudolph
DIOP
Stomatologie
Mme Sokhna BA
DIOP
Radiologie
Mme Elisabeth
DIOUF
Anesthésie/Réanimation
M. El Hadj Fary
KA
Médecine interne 1
M. Mamadou Mourlalla
KA
Médecine interne 1
M. Oumar
KANE
Anesthésie/Réanimation
M. Abdoul Aziz
KASSE
Cancérologie
Mme Aminata DIACK
MBAYE
Pédiatrie
M. Mouhamadou
MBENGUE
Médecine interne 1
M. Amadou Koura
NDAO
Neurologie
M. Ousmane
NDIAYE
Pédiatrie
M. Cheikh Tidiane
NDOUR
Maladies infectieuses
M. Alain Khassim
NDOYE
Urologie
M. Ndaraw
NDOYE
Neuro- Chirurgie
M. Paule Aïda
NDOYE
Ophtalmologie
M. Abdou
NIANG
Médecine interne 1
M. Abdoulaye
POUYE
Médecine interne 1
Mme Anne Aurore
SANKALE
Chirurgie Générale
Mme Anne
SARR
Médecine interne Il
Mme Fatou
SENE
Neurologie
Chirurgie
M. El Hassane
SI DI BE
Médecine interne 1
M. Masserigne
SOUMARE
Maladies infectieuses
M. Charles Mouhamed
SOW
OrthopédiefTraumalologie
M. Abdourahmane
TALL
O.R.L
M. Silly
TOURE
Stomatologie
ATTACHES CHEFS DE CLINIQUE
M.Oumar
BA
Pneumophlrsrologre
Mme Binta DIOP
BADIANE
Anesthésie/Réanimation
M. Sa'rba
CISSOKHO
Pneumophtisiologîe
M. Mor
NDIAYE
Pneumophlisiologie
ATTACHE - ASSISTANT
M. Néloum
DJIMADOUN
Histologie/Embryologie
11- PHARMACIE
PROFESSEURS TITULAIRES
* * *
M. Doudou
BA
Chimie Analytique et
Toxicologie
M. Emmanuel
• M. Babacar
BASSENE
Pharmacognosie
FAYE
Pharmacologie!
Pharmacodynamie
M. Issa
• M. Souleymane
• M. Oumar
La
Pharmacie galénique
MBOUP
Bactériologie-Virologie
NOIR
Parasitologie
MAITRE DE CONFERENCE AGREGES
M. Mamadou
BADIANE
Chimie thérapeutique
M. Cheikh Saad Bouh
BaYE
Bactériologie-Virologie
M. Mounirou
CISS
Toxicologie
M. Balla Moussa
DAFFE
Pharmacognosie
Mme Aïssatou GAYE
DIALLO
Bactériologie-Virologie
Mme Aminata SALL
DIALLO
Phsysiologie pharmaceutique
M. Alioune
OlEYE
Immunologie
M. Pape Amadou
DIOP
Biologie pharmaceutique
MAITRE ASSISTANTS
M. Aynina
CISSE
Biochimie
M. Amadou
DIOUF
Toxicologie
Mme Rita BEREHOUNDOUGOU NONGONIERMA
Pharmacognosie
M. Matar
Chimie organique
SECK
ASSISTANTS
Mlle Issa Bella
BAH
Parasitologie
M. Mounibé
DIARRA
Physique pharmaceutique
Mlle Thérése
DIENG
Parasitologie
M. Amadou Moctar
DIEYE
Parmacologie et
Pharmacodynamie
M. Yérim Mbagnick
DIOP
Chi(Tlie analytique
M. Ahmédou Bamba K.
FALL
Pharmacie galénique
M. Djibnl
FALL
Pharmacie chimique et
Chimie organique
M. Modou
LO
Botanique
M. Augustin
NDIAYE
Physique pharmaceutique
M Mamadou
NDIAYE
Pharmacologie
Mme Philoméne LOPEZ
SALL
Biochimie pharmaceutique
M. Elimane Amadou
SY
Chimie générale et
minérale
M.Oumar
THIONE
Pharmacie galénique
M. Alassane
WELE
Chimie physique
Mlle Maguette Deme Sylla
NIANG
Biochimie - Immunologie
ATTACHES
M. William
DIAnA
Botanique
Mme Amy Thiam
FALL
Chimie analytique
M. Mamadou
FALL
Toxicologie
Mlle Edwige
GOMIS
Pharmacognosie
M. Amadou
SARR
Phyiologie pharmaceutique
111- CHIRURGIE DENTAIRE
PROFESSEURS TITULAIRES
M.lbrahima
BA
Pédodontie - Prévention
Mme Ndioro
NDIAYE
Odontologie préventive et
Sociale
MAITRES DE CONFERENCES AGREGES
M. Boubacar
DIALLO
Chirurgie Buccale
M. Papa Demba
DIALLO
Paradontologie
Mme Charlolle Faty
NDIAYE
Chirurgie buccale
M. Mallck
SEMBENE
Paradontologie
MAITRES- ASSISTANTS
M. Falou
DIAGNE
Orthopédie dento-faciale
Mlle Fatou
GAYE
Dentisterie opératoire
M. Abdou Wahab
KANE
Dentisterie opératoie
M. Mohamed Talla
SECK
Prothèse dentaire
ASSTSTJfJVT5rm~zrcr L TE
Mme Christiane Johnson
AGBOTON
Prothèse dentaire
Mme Aïssatou Ba
TAMBA
Pédontie - Prévention
Mme Khady Diop
BA
Orthopédie dento-faciale
M. Daouda
CISSE
Odontologie préventive et
Sociale
Mme Adam Marie A Seck
DIALLO
Paradontologie
M. Lambane
DIENG
Prothèse dentaire
Mme Affissatou Ndoye
DIOP
Dentisterie opératoire
Mme Fatou
DIOP
Pédontie - Prévention
M. Libasse
DIOP
Prothèse dentaire
M. Mamadou Moustapha
GUEYE
Odontologie préventive
Et sociale
M. Mallck
MBAYE
Dentisterie opératoire
Mme Paulette Agboton
MIGAN
Matières fondamentales
M. Edmond
NABHANE
Prothèse dentaire
M. Cheikh
NDIAYE
Prothèse dentaire
Mme Maye Ndiaye Ndoye
NGOM
Paradontologie
M. Paul Dédé Amadou
NIANG
Chirurgie buccale
Mme Soukéye Dia
TINE
Pathologies et
Thérapeutique
M. Sald Nour
TOURE
Prothèse dentaire
ATTACHES
M. Abdou
BA
Chirurgie buccale
M. Henri Michel
BENOIST
Paradontologie
M. Babacar
FAYE
Odontologie conservatrice
Endodonlie
M. Daouda
FAYE
Odontologie préventive et
Sociale
M. Malick
FAYE.
Pédodontie - Orthodontie
M. Cheikh Mouhamadou
SARR
Odontologie conservatrice
Endodontie
M. Mohamed
SARR
Odontologie conservatrice
Endodontie
Mme Faloumala DIOP
THIAW
Odontologie conservatrice
Endodonlie
M. Babacar
TaURE
Odontologie conservatrice
Endodontie.
Je dédie ce travail
A Dieu le Tout-Puissant,
A son Fils Jésus-Christ, Notre Seigneur,
Au Saint-Esprit,
A mes parents, auxquels je dois .tout ce que je suis, pour leur
affection et leur compréhension,
A Antoinette, ma compagne, pour sa patience et son soutien; ce
travail est aussi le tien;
A mon fils, Jean Alfred.
A mes fréres, sœurs, compagnons et complices
A toute ma famille du Sénégal
A tous mes amis, d'ici et de l'au-delà.
A NOS MAi"rRES ET JUGES
A notre Maître et Président de Jury,
Monsieur le professeur José-Marie AFOUTOU.
Vous nous avez fait l'honneur et le plaisir d'étre notre Président de
Jury; Vous avez toujours manifesté à notre égard une grande disponibilité
et témoigné de beaucoup de compréhension.
Votre savoir, votre sagesse et votre simplicité ont valeur de symbole.
Vous étes pour nous, un des Maîtres les plus estimés. Puissions nous, tout
au long de notre vie, marcher dans vos pas.
Soyez assuré de notre sincère reconnaissance et de notre profond
attachement.
A notre Maître et Juge,
Monsieur le professeur Mamadou BADIANE,
Nous avons toujours été impressionnés par votre volonté et votre
aptitude à partager vos connaissances et vos compétences dans votre
matière, les rapports simples que vous avez établis entre les étudiants et
vous font que vous étes aimé et admiré de tous.
Nous avons gardé de bons souvenirs de vos cours dispensés avec
clarté et précision.
Nous sommes honorès que vous acceptiez aujourd'hui de juger ce
travail. Soyez assuré de notre sincère reconnaissance.
A notre Maître et Juge,
Monsieur le professeur Pape Amadou DIOP,
Nous sommes séduits par la spontanéité avec laquelle vous
avez accepté de juger ce travail, alors que vous ne nous connaissiez pas,
nous vous en remerCions infiniment.
A notre Maître et Directeur de Thèse
Madame le professeur Sylvie SECK GASSAMA,
Vous nous avez marqué par votre rigueur scientifique, votre
dévouement dans le travail, mais aussi, par vos nombreuses qualités
humaines, votre humilité, votre modestie, votre attention à l'égard des
autres et de votre gentillesse qui fait de vous un modéle.
Nous avons apprécié l'aide précieuse que vous avez apporté à la
réalisation de cette Thèse.
Soyez assurée de notre estime et de notre admiration.
,
REMERCIEMENTS
A Monsieur Jean Pierre MANE (Ziguinchor) pour ses nombreux
conseils et sa grande disponibilité,
A Monsieur Babacar MBODJ, pour ses nombreux conseils;
A Madame le Docteur Marième Fall LO (Pharmacie El Mansour) pour
son appui logistique et l'expérience qu'elle a su me transmettre;
A tous les employés de la pharmacie El Mansour, pour leur soutien
moral,
A
toutes
les
personnes
contactées
lors
des
recherches
bibliographiques, pour leur dynamisme et leur efficacité;
A Monsieur Stanislas COLY et Mlle Evelyne GUEYE pour leur aide
dactylographique et leur disponibilité,
A tous ceux qui m'ont aidé, avec beaucoup de patience et de bonne
volonté, à mettre en forme ce document.
" Par délibération, la Faculté a arrêtê que les opinions émises
dans les dissertations qui lui seront présentées, doivent être
considérées comme propres à leurs auteurs et qu'elle
n'entend
leur
donner
aucune
approbation
ni
improbation,"
ABREVIATIONS
HT
=
Hormones thyroïdiennes
Tg
=
Thyroglobuline
TSH =
Thyroïd Stimulating Hormon
TRH =
Thyreotrophin Releasin(J Hormon (la TRH activité fœtale)
T3
=
Tri-iodothyronine
T4
=
Thyroxine
MIT =
Mono iodothyrosine
DIT =
Di-iodothyrosine
TBG =
Thyroxin - binding globulin
TBPA=
Thyroxin-binding prealbulmin
HC
Hypothyro",die Congénitale
=
TPO =
Thyropéroxydase
TOCI=
Troubles dus à la carence en iode
Sommaire
PAGES
1NTRODUCT! 0 N --------------------------------------------------------------------------------
1
PREMlERE PARTlE: REVUE DE LA LITTERATURE
CHAPITRE 1: LA GLANDE THYROïDE ---------------------------------------------------
4
1.
AN ATO M lE ----------------------------------------------------------------------------------------
5
11
HIST0 LOG lE -- --- -- -- -- ---- -- --- -- -- --- -- --------- -- ---- ------- -------- -- -- -- --- -- -- -- -- -- -- -- ----
6
1Il.
PH Y S10 LOG lE ------- -- ---- -- ------ --- -- --------- -- -------- -- --- --- --- --------- ----- ----- -- -------
7
1IL 1- HOIUvlONES THYROIDŒNNES ------------------------------------------------------ 7
III. 2- B10SYNTHESE DES HORMONES THYROlDŒNNES --------------------------- 7
\IL 3- HORMONOG ENESE ----------------------------------------------- --------------------- 9
\IL 4- METABOLISME DES HORMONES THYROIDIENNES CHEZ L'ENFANT --- Il
1fi 4- 1. TRAL'ISPORT ----------------------------------------------------------------------- 11
III 4- 2. CATABOLISME ------------------------------------------------------------------- 11
IV
ACTIVITE DES HORMONES THYROIDIENNES ------------------------------------------ 12
1V. 1 MODE D' ACTION ------------------------------------------------------------------------- 12
IV.2- EFFETS DES HORMONES THYROlDlENNES SUR LES METABOLISMES - 13
IV
TV.
IV.
1V.
V.
2- 1 METABOLlSME BASAL ---------------------------------------------------- 1J
2- 2. METABOLISME GLUCIDIQUE ------------------------------------------- 1J
2- 3. PROTIDIQUE ------------------------------------------------------------------ 13
2- 4. LlPID IQUE --------------------------------------------------------------------- 14
EFFETS DES HORMONES THYROIDlENNES SUR LES TISSUS CIBLES ------------
14
V. 1 CHEZ LE FŒTUS -------------------------------------------------------------------------- 14
V.2 CHEZ LE NOUVEAU-NE ----------------------------------------------------------------- 14
V. J CHEZ L'ENFANT -------------------------------------------------------------------------- 15
VI.
ACTIVITE DE LA THYROIDE FŒTALE -----------------------------------------------------
15
VII.
REG ULA TlON -------------------------------------------------------------------------------------
15
CHAPITRE Il: L'HYPOTHYROIDIE NEONATALE ------------------------------------ 17
1.
HTS TO RJ QUE --------------------------------------------------------------------------------------
18
Il.
METODOLOG lE -----------------------------------------------------------------------------------
19
III.
EPI DEMl OLOG1E ---------------------------------------------------------------------------------
19
1V.
A: PECTS ETI 0 LOGIQUES --------------------------------------------------------------------- 20
IV. 1- TROUBLES DE LA MORPHOGE'iESE ---------------------------------------------- 20
IV. 2- TROUBLES CONGENlTAUX DE L'HORMOGENESE ---------------------------- 21
V.
CUN 1Q UE -- --------------------------------- ------------------------------------------------------- 2 1
V. 1- LES SYMPTOMES ------------------------------------------------------------------------- 21
V.2- LES SIG1\'ES CLINIQUES ---------------------------------------------------------------- 22
VI.
DI AG" OS TIC ------------------- ------------- --------------------------------------------------- --- 25
VI. 1- DIAGNOSTIC ETiOLOGIQl'E ------------------------------------------------------- 25
VI. 2- DIAGNOSTIC DIFFERENTŒl ....---------------------------------------------------- 25
VII.
TRAJ TEMENT ------------------------------------------------------------------------------------- 26
DEUXIEME PARTIE: ETUDE PERSONNELLE
MOYENS ET METHODES
j.
SUJE T ----------------------------------------------------------------------------------------------- 29
11.
MA TERJELS --------------------------------------------------------------------------------------- 29
Il. 1- MATERJEL DE PRELEVEMENT ------------------------------------------------------- 29
Il. 2- MATERJEL DE DOSAGE ----------------------------------------------------------------- 30
II. 2- 1. STAl'IDARDS ET CONTROLES------------------------------------------------- 30
JI 2- 2_ REACTIFS -------------------------------------------------------------------------- 31
II. 2- 3. MATERIEL lJ\'DISPENSABLE NON FOURNI AVEC TROUSSE -------- 32
Il 1.
MET HO DES ---------------------------------------------------------------------------------------- 32
Il 1. 1- CALE1'mRJ ER ---------------------------------------------------------------------------- 32
III. 2- TECHNlQUE ------------------------------------------------------------------------------ 32
III. 3- DOSAGE .-------------------------..--------_..._..._--------------------------------------- 33
III. 3- 1
III. 3- 2.
PRJNCIPE DU DOSAGE --------------------------------------------------- 33
ET APE PRE-ANALYTIQUE ----------------------------------------------- 34
lII. 3- 2. l.
III. 3 2 2.
VERIFICATION DES PAPIERS -------------------------------- 34
PREPARATION DES REACTIFS ------------------------------ 34
1[1. 3. 3. ETAPE AN AL YTIQUE ------------------------------------------------------- 35
III 3- 3. 1 POSITIONNEMENT DES TUBES --------------------.---------- 35
lII. 3- 3 2. INTRODUCTION DES ECHANTILLONS --------------------- 35
III. 3- 3. 3. REALISATION DU DOSAGE ----------------------------------- 35
111.3- 4 DETECTION FINALE
------------------------------------------------~-----
--.
37
RESULTATS
l.
PROFIL DU CALEI\URJER DE PRELEVEMENT ------------------------------------------- 41
1]
PROFIL DE DISTRlBUTION SELON LES SEXES ------------------------------------------ 42
III.
CONTROLE DE Ql.-\L1TE DES PRELEVEMENTS ---------------------------------------- 43
1V.
DOSA GE --- --- --- --- ---------- -- --- -- -------- -- --- ----- --- -- -- -- --- -- ----- ----- ----- -- --------- -- -- - 44
V
CONTROLE DES VALEURS POSITIVES ---------------------------------------------------- 47
COMMENTAIRE
PRE LE VEME NT ---- --- ------ --- ---- ----- ----- -- --- -------- -- -- ----- -------- -- -- ----------- ----- --- 49
Il.
CONTROLE DE QUALITE ---------------------------------------------------------------------- 50
III.
BILAN CRITIQUE DU DEPISTAGE ----------------------------------------------------------- 50
[V.
AUTRE APPROCI-ΠMETHODOLOGIQUE -------------------------------------------------- 51
CONCLUSION
BIBLIOGRAPHIE
INTRODUCTION
2
Le dépistage néonatal de l'hypothyroïdie revêt une importance capitale, eu égard
à l'impact des hormones thyroïdiennes sur le développement du système nerveux et sur
la maturation osseuse.
Les Hormones Thyroïdiennes (H.T.) sont indispensables pour une croissance
normale. Elles agissent au niveau des cartil-=:lges oe croissance, leur action interfère
également avec l'hormone de croissance. Elles ont un rôle fondamental dans la
myelinisation des fibres nerveuses, le développement des axones et des dendrites. La
diminution de leur synthèse par destruction ou blocage de la glande
t~yroïde
entraîne
une hypothyroidie.
Grâce aux dosages radio-immunologiques el immunofluorométriques des
hormones thyroidiennes (T3 et T.) et de l'hormone hypophysaire (TS.H.), l'étude
fonctionnelle de la glande thyroïde est devenue plus facile.
La particularité du dépistage de l'hypothyroïdie chez le nouveau-né dès le
premier jour de la vie réside dans le fait qu'il a non seulement un intérêt diagnostique
venant préciser l'état fonctionnel thyroïdien, mais également pronostique;-en permettant
l'<§tablissement
d'un
traitement
précoce.
assurant
psychomoteur normal chez les enfants hypothyroïdiens.
Notre travail est divisé en deux parties:
Revue de la littérature
Etude personnelle portant sur 522 nouveau-nés.
ainsi
un
développement
3
PREMIERE PARTIE
REVUE DE LA LITTERATURE
;
4
CHAPITRE 1
IILA GLANDE THYROIDEII
5
1- ANATOMIE
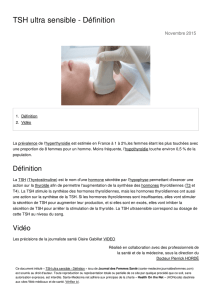
Le corps thyroïde est une glande endocrine lobulée, faîte de follicules thyroïdiens
situés dans un stroma conjonctif vasculaire riche en capillaires sanguins fenêtrés (10)
(figure 1).
Il est d'une coloration rose tirant sur le rouge plutôt clair, une cor.sistance molle,
en réalité légèrement mamelonnée, parfois rompue par des sillJns, voire des encoches,
surtout à la fonction de l'isthme et des lobes latéraux (9).
Son volume est sujet à de nombreuses variations individuelles et en fonction de
l'age; son pOids normal est de 25 à 30 grammes avec des extrêmes allant de 10 à 60
grammes (B).
Oans 65 % des cas environ chez l'adulte, les lobes latéraux sont réunis par un
isthme large et mince donnant à l'ensemble en aspect de H. Mais il arrive que l'isthme
soit plus court, haut et épais. A l'inverse, dars le type fœtal, les lobes latéraux
s'accolent en V sur la ligne médiane, sans isthme individualisé.
La position de la tête en hyper- extension permet de dégager le corps tyroTde en
démasquant son
pôle inférieur des muscles sterno-deidomastoi"diens (3).
La
vascularisation et son drainage lymphatique sont important. Les artères thyroi"diennes
sont principalement:
l'artère thyro"idrenne supérieure
j'artère thyroi"dienne inférieure.
Les veines thyroïdiennes sont de nombre et de topologie très variables.
Le drainage lymphatique se fait par les chaînes spirales, cervicales, jugulocarotidiennes, réeurrentielles et médiastinales supérieures.
L'innervation est assurée par les systèmes sympathiques et parasympathiques.
Car',r;lqc
CriC, .(j/.
~}
... ;.j ..... ,ir,
r. ". r' ~ l~
1
Artère carotide externe
~
Arlére IhyrOldienne
supérieure
ëll)e gauct1"
- 'rps 1My(('
Lobe droil du
corps Ihyroïde
----------.r-
Trachée
Pyramide de
Lalouelle
_---+-itî-ï
\.~·Ine
Isthme du
corps rhyroïde
Artère Ihyro"'dienne
inférieure
(......
.....1~ \. -
------i---t{--=~"t,~l
-------1~
.- ,
Figure 1, Le Corps Thyroïde et ses vaisseaux
(à droite les veines, à gauche les artères)
.-~
- , ......
~
:t:
6
II.
HISTOLOGIE
Le parenchyme thyroïdien est formé de lobules résultant de la coalescence des
follicules thyroïdiens (ou vésicules thyroïdiennes). Les follicules thyroïdiens sont l'unité
fonctionnelle de la thyroide ; ils sont grossièrement sphériques, d'un diamètre d'environ
300 microns (31), (figure 2)
Chaque follicule est une sphère creuse formée d'une assise de cellules
épithéliales, les thyréocytes, limitant une cavité centrale remplie d'une substance
protéique, la colloïde, (figure 3). La colloïde est un gel semi-visqueux contenant de la
thyroglobuline (Tg) et d'autres protéines iodées. Les hormones thyroïdiennes sont
stockées
dans la colloide (35); normalement les cellules thyroïdiennes sont
grossièrement cubiques.
Leur morphologie change selon l'état de stimulation et d'activité du follicule. Les
cellules d'un follicule au repos sont aplaties avec une grande cavité centrale et une
accumulation de collcïde. Au contraire, lorsque le follicule est -stimulé par la Thyroxin
Stimuling Hormon (TSH), les cellules augmentent de hauteur, prennent un aspect
« palissadique » et la taille de la cavité centrale se récuit. Cependant, ceci n'est que
schématique. La TSH et bien d'autres facteurs ayant des effets sur divers paramètres
de la fonction thyroïdienne, la quantité de colloïde n'est pas nécessairement corrélée à
la stimulation thyroïdienne
En fait, les follicules d'une même thyroïde sont trés
hétérogénes en taille et en activité (30, 42). La thyroide renferme d'autres cellules que
les
thyréoc~~s, le~-"ellules
C_ElIe.reprèsenteoJ 1 à2 % de l'ensemble des cellules
thyroïdiennes-
Elles sont isolées ou en petits groupes dans le parenchyme thyroïdien, soit entre
les follicules, soit entre la membrane basale et les cellules folliculaires. Elles sécrétent
la thyrocalcitonine, ainsi sans doute que de nombreux autres peptides (SRIF,
Sérotonine, bombésine, ACTH). Le marqueur biologiques des cellules vésiculaires est
la Tg. Le marqueur biologique des cellules C est la calcitonine. Les deux sont bien mis
en évidence sur coupes histologiques pas immunohistochimie (46).
"
follicule thyroïdien rempli
tissu conjonctif lâche
'lIicl !!e thyroïdien vidé
Figure 2 : Coupe hislologique de la glande thyroïde
thyréocyte - -
rést.·au
libre nerveuse amyélinique
1
1 iglll"c .\.
A..'
follicule thyroïdien
L
artériole
pit:
re
7
111- PHYSIOLOGIE
111- 1. Hormones thyroïdiennes: T, et T, (figure 4).
Les principales hormones thyroïdiennes sont.
-la thyroxine: 3,5,3',5' - tetra - iodothyronine, ou T4
la 3,5,3' - tri - iodothyronine, ou T3.
Une désiodation périphérique de T4 en T3 donne à la T 4 , au moins en partie, un
rôle de prohormone de la T3.
Les hormones !hyroïdiennes sécrétées dans le règne
animal sont les isomères lévogyres, L-T4 et L-T3
III· 2. Biosynthèse des hormones thyroïdiennes (37, 48, 57)
Tableau 1, (figure 5) .
L'iode est absorbé de l'intestin vers le sang où il circule sous forme d'iodure (1").
La thyroïde capte l'iode circulant avec un gradient de concentration de 20 à 40 par
rapport au sérum. Le transport de l'iode._du sang vers la cellule épithéliale, à travers la
membrane basale, est un phénomène actif Puis l'iodure est oxydé en iode (21"
~ 12 +
2
el Il est ensuite organifié c'est-à-dire lié à la thyrosine pour former des monoiodothyrosines (MIT) et dl-iodothyrosines (DIT).
L'oxydation et l'organification sont catalysées par la péroxyda se thyroïdienne.
Celle-ci
cat~l.1'Se,-"lJSsi
les couplages des iodothyrosines pour former T3 et T4. La
thyroglobulinlL(T9h.-.siluée_.aLLcentre..-dans IELcoiioIde porte MIT, DIT, T3 et T4 . Le
couplage se fait à l;intérieur
deJaJhy~ogJnbuline.
PulsJ:>-et T.. sont libérées à partir de
la thyroglobuline, Jravecsent la cellule épithéliale et passent dans la circulation. MIT et
DIT, non utilisées pour la synthèse_de T3 et T.., passent aus.si du colloïde dans la cellule
épithéliale. L'iode est alors_séparé de la thyrosioe el ré· utilisé.pour la.synthèse de T3 et
T 4. Le défaut de désiodase est responsable d'ut:1e libération-.dans Je sang d'une quantité
importante de MIT et DIT et de leur perte dans les urines,
La thyroïde produit 100 % de la T4 , 20 % de la T3 et 5 % de la réserve T3 (rT3).
Celle-ci a une faible activité biologique. Le reste de T3 et rT 3 vient de la conversion de
T4 au niveau du foiE et du rein essentiellement. Ainsi, 40% de la T4 se transforme en T3.
.Monoiodol yrooine (rAIT)
1
1
2\\
li'
/
NH?
HO..:c"/.'"-_=~=:..,.\,-CHi"·~"
/
"C{)OH
Oiiodol yr(lsinc (D!T)
Il
2
r.--",
HO.1.!
NH2
1
')-CH2-CH
'\~- .~
• -
~.
,.... ....,;"'.'J
~v.~
.... rl
1
Triicciothyronintl ": T3
~
3
'l':'
<l • ,
HO.J/
\5
~j'il-i2
-;:;;-.
. ' . J "~~\.
t'-']'4"
•
",".'
.... _'j. ..
\''P,!-CH'..C!"'(
.-v
b'/
\;J~.
6/
'-. . ça"""
,
uM'
... .-'..:,..,
Trlioco:hywnlnr::: !T3
.~ '.~
3-6-3'-6'
!ilyroxlne (T~)
•
.-"--,,
... J'
HO.l1'/;
~"
,:.1
'i -
2·..·
13
,
/'
\\Io~//
2
, 1
\\
.-
. NH2
\'r-CH2-Ctf.
~'-COOH
6 ' . / '' _ _
,
---'
' J
6'1
G
Figure 4: Les Hormones thyroïdiennes
8
Dans le plasma, la fraction libre des hormones thyroïdiennes est faible. En effet,
moins de 0,5 % circule sous forme libre. Le reste est lié à des protéines de transport :
«thyroxin- binding globulin»
(TBG), «Thyroxin-binding préalbumin»
(TBPA) et
albumine. Les taux circulanls normaux (moyennes et limites) chez l'enfant sont:
8~g/1 OOml
(5 à 12) pour T, Totale, et 0, 13
~g
11 OOml (0,08 - 0,22) pour T3 Totale.
ETAPES DE LA SYNTHESE
1. Absorption de l'iode de l'intestin vers le sang
2. Captation de l'iodure par la thyroïde
13. Oxydation de l'iodure en iode
4. Liaison de l'iode à la thyrosine
~
LIEU
Sang
Cellule folliculaire
Cellule folliculaire
Thyroglobuline
(colloïde)
5. Couplage des iodothyrosines --> T3 et T,
6. Libération de T3 et T, de la thyroglobuline
Thyroglobuline (colloïde)
Cellule - Sang
et passage à travers la cellule folliculaire
vers le sang
7. Récupération de l'iode des iodothyrosines
Cellule folliculaire
non utilisées
Tableau 1: Etape de la synthèse des homnones thyroïdiennes d'après BRAUNER R. et
FONTOURA M. (6)
1
,
1co)]
'0 .
.dei
f
~
~
r
J
1
1
j Thyrc<j1.obbil nej
1
1-
roilee
_
1
/'
Tl1yy~ocyWS 1
1
1
1 Sih"lj/
•
ry,·C.'>; '"le
GLy t~t~
-----..c==-.--~ ~
.~
ltrl--;c..dcthyrC'rlllX:-'
ï <\- (Thyu:,xl
l'li:)
Figure 5 : La biosynthèse des hormones' thyroïdiennes
9
111.3 Hormonogenèse
Dans le sérum (ou le plasma) du fœtus, les concentrations hormonales ont une
évolution pouvant être schématisée:
0" Pour la tyroxine (T4 ) les données sont bien précises. Elle apparaît dans le sérum
vers la douzième semaine
jusqu'à
de gestation, et son taux reste stable vers 2IJg/1 GOml
20 semaines, puis le taux s'élève progressivement jusqu'à terme.
La T4 drcu/ante se trouve sous deux formes·
•
Une forme libre ou FT 4 dont la concentration s'élève aussi progressivement du
milieu de gestation jusqu'à terme;
•
Une forme liée essentiellement à la TBPA (Thyroxin Binding Pre-Albumin).
Dés 24 semaines, T, est liée à 85 % à la TBG (Thyroxin Blnding Globulin) apparue
dans le sérum comme TBPA et T 4 vers la 12
eme
'.
semaine el dont le taux va en croissant
en raison de l'effet des oestrogènes maternels sur sa synthèse hépatique.
cr Pour la tri-iodothyronine (T3) et la reverse (T3) (3, 3', 5', tri-iodothyronine ou
rT 3), les données actuelles sont les suivantes:
Selon FISHER (DA) et KLEIN (A.S.) (20), 13 est habituellement indétectable avant
30 semainas d'âge gestalinnneL puis le taux passe de (15 - 20) ng/100ml en moyenne
à terme.
Inv~rs.emenUe...laill'-de rT3-baisse progr.essivement de l'âge de 30 semaines
jllSqll'à terme
Le taux très bas de T3 et le taux élevé de rT 3 durant la majeure partie de la vie
foetale, peuvent être expliqués par la transformation hépatique de T4 en T3 qui est
déficiente en raison d'une concentration insuffisante en S' d..~sîad~.
dans les tissus
.
-..~
...
périphériques et notamment dans le foie, car ils ont montré que les homogénats de-foia
fœtal ne transforment pas T4 en T3; par contre, Ja transformation de T 4 en rT 3 par
désiodation
en position 5 esl possible et d'ailleurs préférentielle.
10
Chez les nouveau-nés â terme, les taux sont les suivants dans le sang du cordon
d'après CZERNICHOW (P) (13).
Pour T. on a [(12,0 ·,0,22) 103 ng/100ml] et FT. (1,85·,0,22 ng/100ml) sont
3
semblables à celles de la mise avec T. [(12,8·.1,4) 10 ng/10üml]; FT. (1,4·, 0,16
ng/100 ml)
Pour T3 [(49·, 6) 103 pg/100ml] et FT3 (150·, 20 pg/100ml) sont nettement
plus bas que ceux de la mère avec T3 [(145 •. 12) 103 pg/100ml] et FT3 (310 ., 40
pg/100ml)
La thyroglobuline est beaucoup moins élevée dans le sang du cordon que celui
de la mère, ce qui suggère, l'absence de transfert.
Selon PEZZINO (V) et COLL (41), on a 24,4
~g/ml
chez le fœtus et un taux de
12 ng/ml dans le sang maternel.
La T8G (24,7 ., 5, 1 ~g/1 OOml) est plus basse que chez la mére (46.3 .,
14
~g/1
OOml).
La TSH (5,5·, 2,5 ~UI/ml) est plus élevée que dans le sang de la mére qUI
est de (2,0·,1,3 ~ UI/ml).
Nouveau-né à
Nouveau-né
terme bien
à terme
Portant
malade
Sang du cordon
37+- 3
40·,6
31·.3
34·, 4
Sang du 0 - 14
55·, 4
32 +- 6
36 +, 3
28 +, 6
Prématuré bien
Prématuré malade Portant
Jour
Tableau 2 : Taux de la thyroglobuline plasmatigue (en ng/ml) d'après BLACK
(EG,) et COLL (4).
Il
111.4.
Métabolisme des HT chez l'enfant.
111.4.1 Transport
Pour la quasi totalité de la production hormonale, le transport dans le sang se fait
par les vecteurs protéiques spécifiques de T4 et de T3 qui sont fixés par des liaisons
propres et labiles.
La fonction principale de ces vecteurs protéiques est de contrôler la fraction libre
biologiquement active des Hl ;elle ne représente que 0,02 % du total de la T4 sérique
et 0,3 % de la
h C'est cette faible partie de la T 4 qui est transformée en périphérie.
Les protéines de transport sont au nombre de 3 :
la thyroxin-Binding Globulin (TBG)
la thyroxin-Binding Pre-albumin (TB PA)
l'albumine.
La demi-vie des hormones liées est de !'ordre de 3 à 5 jours pour T3, 6 à 10 jours
pour T4 , mais la fraction libre se renouvelle 100 fois par minute. Un des modes de
disparition des hormones est la déshalogénalion. Celle-ci constitue le mode préférentiel
de production de T3 au niveau cellulaire à partir de la T 4.
111- 4, 2.
Catabolisme (figure 6).
Le métabolisme périphérique des hormones thyroïdiennes utilise un certain
nombre
de voies métaboliques classiques telles que les conjugaisons et la
désamination
oxydative.(53)
Ces
hormones
thyroïdiennes
sont essentiellement
métabolisées au niveau du foie, du rein, du cerveau et du muscle. Le processus le plus
important est la désiodation, notamment la conversion de T4 en T3 au niveau des tissus
périphériques (4).
La T4 est peut-être considérée comme une pro-hormone de réserve, circulante
puisque la seule forme hormonale active intra-cellulaire est le T3. 80 % de la T4 est
transformée en T3 par monodésiodation; le reste est métabolisé par trois autres voies:
D~SIODATION
/
1
1
/HO~<
\.
>,-
'-5 6
il
)'
CONJUGAISON
~
'\
i -",_~/-
,····_········,······t ''' ...
J
0 -
Il
~ ~
/3 2'
À
[ 1
1
~I
i_~
. DESAMINATION
~
oc
Ôl'-CH2-'CH
2
~-,
,
Pont PHOSPHODIESTER
.
/
"
NH 2'
COOH
.
1
1
DECARBOXYLATION
ŒSIODATION
Figure 6 : Sites des transformations métaboliques des hormones thyroïdiennes
12
les sulfo et glycuroconjugaison.
la décarboxylation et la désamination oxydative
le clivage du pont ester qui permet d'obtenir la di-iodotyrosine ; il représente
une infime partie du métabolisme des hormones thyroïdiennes.
La monodésrodation de T4 est de grande importance biologique et selon
l'emplacement de la désiodation ou obtiendra soit de la T3 (3. 5,3' - tri-iodothyronine),
dont l'activité biologique est 3 il 5 fOIS plus grande qL'e celle de T" soit de la T3 reverse
(3 - 3' - 5 - tri-iodothyronine ou rT3 ) d'activité biologique nulle (cf schéma).
5' - monodésiodation
5 monodésiodation
T 3 et rT 3 sont ensuite métabolisés en composés di-iodés (T2) puis monoiodés
(T,).
IV
ACTIVITE DES HORMONES THYROIDIENNES
IV- 1. Mode d'action (figure 7).
L'action des hormones thyroïdiennes au nÎveau cellulaire n'est possible que pour
la fraction libre de T4 et surtout de T3 , mais l'entrée dans la cellule fait intervenir un
transporteur protéique spécifique.
,
,
IU'~('I'.rrll'
1
,
T:r
/1\
•
'"
? ,..,Ss
.,0;"\
'1
r1 d--.. ()· ~
\.1
DNA
~
fZ:'CY/..~
---r+-ICh ro 111:1 ( j Il ('
~.
o
1
Ill()tfiJ1C~
•
:~. ~
,
1(0 ~::---:---
. l
;\~l~O
III
n
1\
1
.'
l
f roléil1c
lipé'ej ri qur
llilldillg
nrlltrill
Figure 7 : Modèle explicatif de l'action de la triiodothyronine
13
En pratique, seule la T 3 exerce une action hormonale au niveau cellulaire el l'on
considère de plus en plus la T 4 comme une pro-hormone de réserve circulante.
Les
hormones agissent en contrôlant l'expression,
voire
la
vitesse
de
transcription de certaines gènes cibles (31). La T3 active la synthèse de RNA cellulaire
et élève les oxydophosphorylations. T oules les fonctions métaboliques sont Îilfluencées
par l'hormone thyroïdienne et les activations enzymatiques intensives se traduisent par
une consommation énergétique accrue, ce qui élève le métabolisme de base.
IV-
2. Effets des hormones thyroïdiennes sur les métabolismes.
IV- 2. 1. Métabolisme basal (15 ,21, 36)
Les HT augmentenlla consommation d'oxygène et la production de chaleur.
Le mécanisme de ce phénomène est complexe et fait intervenir divers sites d'action des
HI. el l'interférence avec d'autres hormones également calorigéniques.
.découpage de la phosphoryiation oxydative n'est plus retenu.
L'axe hypothalamo-hypophysaire intervient également:
•
l'exposition au froid entraîne une libération de TRH puis de T5H ;
•
l'exposition à la chaleur a l'effet inverse
IV- 2. 2. Métabolisme glucidique
Les HT ont une action hyperglycémiante.
IV- 2. 3. Protidique
Les HT activent la synthèse protéique.
Le rôle du
14
IV -2. 4. Lipidique
L'action des hormones est complexe. A taux physiologique elles activent la
synthèse du cholestérol, mais l'inhibent â des concentration élevées. Elles augmentent
l'excrétion biliaire du cholestérol et son excrétion fécale.
En hypothyroïdie, l'effet sur l'excrétion fécale est plus diminué que l'effet sur la
synthèse, ce qui explique i'hypercholestérolémie.
IV.3
Effets des hormones thyroïdiennes sur les tissus cibles (45).
IV- 3. 1. Chez le foetus
Les hormones thyroïdiennes interviennent dans la croissance en favorisant la
maturation osseuse, comme en témoigne le retard osseux avec parfois dysgénésie el
épiphysaire des nouveau-nés hypothyroïdiens.
Les nouveau-nés atteints d'hypothyroïdie congénitale ont souvent un poids
inférieur à 2500 9 mais la prématurité est alors fréquente.
lV- 3. 2. Chez le nouveau-né
Il a été démontré que les Hl jouent un rôle essentiel dans le
développement des axones et des ramifications dendritiques ainsi que dans la
myélinisation des fibres nerveuses en raison de leur rôle dans le système des
lipoprotèi~es.
Dans la croissance somatique: les Hl jouent un rôle important dans la
croissance
•
somatiqu~
post-natale. Cette action s'exerce à divers niveaux:
au niveau du cartilage de conjugaison, elles entraînent une activation du
cartilage sérié et hypertrophique, 'une accélération de la maturation du cartilage calcifié.
•
elles augmentent la vitesse d'ossification des épiphyses et des os de
15
m9mbrane. Elles agissent directement, en activant les synthèses protéiques et aussi en
synergie avec l'hormone de croissance, et en renforçant l'activité de la somatomédine.
IV- 3. 3. Chez l'enfant
Leur action se traduit donc par un effet fondamental sur la croissance en général,
mais plus spécifiquement sur la croissance osseuse et sur l'élaboration du cerveau
V-
ACTIVITE DE LA THYROïDE FŒTALE
Elle commence vers la 8eme semaine de gestation avec la production de
thyroglobuline. Vers la dixième semaine, la thyroïde commence à capter l'iode et à
ioder la thyrosine. Vers la 12e semaine, l'antéhypophyse fœtale commence à sécréter la
TSH.
Au milieu de la gestation, l'axe hypothalamo - hypophyso-thyroïdien fœtal est
fonctionnel. " ést indépendant de celui de la mère. En effet, la TSH et les hormones
thyroïdiennes ne traversent pas le placenta. Seul le TRH traverse le placenta. Aussi,
l'administration de TRH à la mère est utilisée pour stimuler la maturation du fœtus
prématuré. Lors de l'accouchement, il ya une augmentation de la TSH du nouveau-né.
Puis celle-ci diminue pour atteindre des valeurs normales «5 mUII) vers le
r
jour de
vie. Le taux élevé de TSH entraîne une augmentation du taux circulant des hormones
thyroïdiennes. Ces modifications transitoires conduisent à faire le prélèvement pour le
dépistage systématique de l'hypothyroïdie vers le 4e au 6e jour de vie.
VI- REGULATION
Le fonctionnement de la glande thyroïde est principalement régulé par l'axe
hypothalamo-hypophysaire (31). La thyréostimuline hypophysaire (TSH) règle à la fois
le niveau de fonctionnement de la thyroïde, la qualité de diverses opérat!ons de
biosynthèse et la sécrétion des hormones dans le sang.
Le taux de sécrétion de TSH, est en retour, sous la déJpendance d'un mécanisme
de rétrocontrôle par le taux de T4 et surtout de T3 du plasma (figure 8).
,
16
La
T3
reverse
ne joue
pas
de
rôle
de
rétrocontrôle.
Une
hormone
hypothalamique, TRH (thyréotrophin Releasing Hormon) isolée et synthétisée, régie la
relâche hypophysaire de TSH selon les besoins hormonaux car elle est sensible
également aux taux plasmatique de TSH, mais aussi de T4 el T3.
Sur ce double rétrocontrôle viennent aussi se greffer des influx corticaux et sous
corticaux en relation avec l'état psychique et émotionnel. (53)
<-
-,-
i-t Y[:;'O\:> HYSC
ïSI1
.
~
-,
-
ïhY~OlD~
r
Figure 8 : Auto-régulation des sé~rétions thyroïdiennes
17
CHAPITRE 2
L'HYPOTHYROIDIE
NEONATALE
18
1-
HISTORIQUE
Le syndrome de l'hypothyroïdie était bien connu avant l'avènement du dépistage
systématique de cette affection. Curling (12) a décrit en 1850 le cas du 1" enfant
présentant des signes cliniques d'hypothyroïdie congénitale avec absence de thyroïde â
l'autopsie, alors qu'Osier (40) a fait le lien entre l'insuffisance de la fonction
thyroïcienne et les changements rencontrés lors du crétinisme.
L'utilisation des extraits thyrQïdiens pour le traitement de l'hypothyroïdie était
possible grâce â Murray dés 1891 (39), Il restait â établir un diagnostic précoce
permettant d'éradiquer cette cause de retard mental. Ce fait étant confirmé par le
rapport de Raiti dans lequel, Newns et Klein (26, 47) montraient que la destruction du
cerveau était irrémédiable si le traitement n'avait pas commencé avant l'âge de 3 mois;
alors que Jacobsen et Braust (24) rapportaient qu' 1/3 seulement des nouveau-nés
atteints étaient cliniquement diagnostiqués avant l'âge crucial
Au début des années 1970. les essais en radio-immunologie sensible et
spécifique pour la thyroxine (T.) et la TSH ont permis la naissance du programme de
dépistage de l'hypothyroïdie congénitale.
En 1972, la concentration de T 4 était mesurée a partir de prélèvements de
gouttes de sang recueillies sur papier filtre et obtenues durant le dépistage de la
phénylcétonurie par le centre de recherche québécois de Médecine génétique (17,18).
Le programme de dépistage était opérationnel en 1974 et offert â toute la population de
la province (100.000 nouveau-nés par an) (19). Klein et Coll sont arrivés â dépister et
détecter les enfants atteint d'H.C en mesurant la 'concentration en TSH (27).
Cette méthode a rapidement été adoptée par les autres programmes de
dépistage en Amérique et en Europe (8, 49). Elle permettait la confirmation du
diagnostic de l'hypothyroïdie tout en éliminant les faux positifs. L'influence des comités
formés par les Associations thyrGïdiannes européennes et américaines a stimulé Je
développement des programmes de dépistage dans la plupart des provinces et états
nord-américains, européens, japonais et aU:itraliens contrairement aux pays d'Europe
de l'Est, d'Asie, d'Afrique et d'Amérique latine (11,33).
19
11-
METHODOLOGIE (51)
L'hormone mesurée pour le dépistage est, selon les pays, la T 4 ou la TSH.
Certains pays mesurant les deux hormones mais ceci accroit le coût du dépistage. Le
dosage de la TSH a pour inconvénient de méconnaître les hypothyroïdies d'origine
centrale. Celles-ci sont en fait beaucoup plus rares que les hypothyroïdies d'origine
périphériques. Le dosage de T 4 permet, en théorie, de dépister les deux types
d'hypothyroldie. Cependant, certains enfants ayant une hypothyroldie par ectopie de la
glande thyroïde ont une T 4 maintenue dans la zone normale basse grâce à une
hyperstimulation de la thyroïde par la T5H. Dans celle situation, l'hypothyroïdie risque
d'être méconnue par le dépistage si on ne mesure que la T 4
En France, le dépistage est fait par le dosage de la T5H. En fonction du taux de
TSH, on se trouve devant une des situations suivantes:
- < à 20mUI/I signifie fonction thyroïdienne normale
- 20 à SOmUIII, un 2 ème prélèvement est demandé pour le dosage.
- > à SOmUI/I, l'enfant est convoqué pour examens cliniques et complémentaires.
111- EPIDEMIOLOGIE .
En dehors des troubles de IJhormonogénèse, dont la transmission est récessive
aulosomique, J'hypothyroïdie congénitale est une affection qui est répandue de façon
universelle avec des variations raciales (2, 7) laissant apparaÎtre un caractère de
susceptibilité génétique. Cependant, cette expression génétique n'est pas directement
transmissible.
Les données épidémiologiques ont indiqué une fréquence de la maladie entre
1/3500 et 1/4000 naissances pour les populations européennes et nord-américaines
avec une prépondérance féminine (2/1) (20, 21); alors que la fréquence apparaît
beaucoup plus basse au Japon 1/5500 (23). Elle est plus importante chez les blancs
(1/3000) et moins iréquente chez les noirs (1132000). Peu de données existent pour les
pays en voie de développement où les fréquences semblent cependant comparables
avec 1/3661 en argentine, 1/2943 en Turquie (54).
20
1V-
ASPECTS ETIOLOGIQUES.
Nous avons des troubles congénitaux de la morphogénèse et des troubles
congénitaux de l'hormogénèse. Les statistiques des affections thyro'idiennes font état
d'une prédominance de la fille, 7 à 8 pour 10 malades, particulièrement dans les
troubles de la morphogénèse ainsi que dans la thyroYdite (2).
IV- 1. Trouble de la Morphogénèse
Avant la pratique du dépistage systématique, la date du diagnostic était
proportionnelle à la gravité de la maladie. ainsi les ectopies ayant une fonction
résiduelle étaient diagnostiquées assez tardivement.
- les athyréoses entraînaient une déficience immédiatement décelable.
- L'ectopie est une masse de tissu thyroldien situé dans le canal thyréoglosse, la
situation à la base de la langue étant la plus fréquente. On a décrit des ectopies
.-doubles ou des anomalies morphologiques assimilables à des ectopies: lobes uniques.
Il semble y avoir dans ces trouble un défaut organisationnel car il est possible de
retrouver totalement, à l'endroit normal des lobes, des formations pouvant correspondre
à des lobes atrophiés aussi bien dans les ectopies que dans les athyréoses. (52) Les
ectopies de gros volume sont une cause intéressante de faux négatifs du dépistage,
soit que l'on ne dose que la T4 , soit que le niveau de la TSH est normal à la naissance;
les enfants peuvent avoir un test de dépistage négatif et donc considérer à tort comme
ne pouvant être hypothyroYdien, la pratique des examens thyroYdiens de contrôle devant
tout nanisme est donc un réflexe obligatoire (22, 50) ; les nodules glandulaires d'ectopie
sont capables d'une survie fonctionnelle plusieurs années après la naissance lors de
l'arrêt de traitement (32). C'est à ce titre qu'une sécrétion résiduelle assurait la
préservation des cellules nerveuses et que les ectopies reconnues avant le dépistage
avaient la réputation de fournir le contingent des sujets les plus brillants (44), tandis que
l'athyréose avait la réputation opposée du fait d'un déficit profond en hormones
thyroïdiennes et par la même en facteurs trophiques du système nerveux. (20).
21
IV- 2. Troubles congénitaux de l'hormogénèse
Ils constituent un groupe de pathologie d'un intérêt théorique très grand, car il
suppose des troubles enzymatiques, donc un défaut génétique, qui pourrait être
déterminé par biologie moléculaire. Ces troubles se conçoivent comme entravant
'Gnacune des étapes de la biosyntèse des hormones thyroidiennes et des principaux
mécanismes impliqués dans celle-ci: synthèse de la Thyroglobuline, de la Peroxydase
(thvropéroxydase (TPQ) et le systeme générant l'eau oxygenée) nécessaire à son
fonctiof1nement et synthèse de la pompe â iodures.
On distingue plusieurs phases qui sont toutes susceptibles de donner un trouble
spécifique:
- transport actif de l'iode dans la thyr61de ,
- oxydation de l'iodure et sa fixation à des résidus thyrosine dans la thyroglobuline gràce à la TPQ permellant la formation de mono- ou di-iodothyrosines
(MIT,
DIT] ,
- couplage des
rés~dus
iodC?thyrosine en iodothyronine catalysée par la même
TPQ ,
- protéolyse et libération des formes hormonales à partir de la thyroglobuline;
- désiodation aux formes non hormonales et recircu\ation de l'iode;
- enfin, synthese cytoplasmatique de la thyroglobuline.
v-
Clinique (56)
V-
1. Les symptômes
Les symptômes qui peuvent orienter ce diagnostic chez un nouveau-né se
manifestent au cours des premières semaines et s'accentuent avec le temps, sont
multiples, l'hypothermie
néonatale étant le premier signe. Il faut couvrir l'enfant
rapidement pour qu'il ne se refroidisse pas. Les difficultés respiratoires initiales sont
rares, sauf en cas de goitre. volumineux. La prise des biberons est longue et difficile:
l'enfant s'endort, ne finit pas ses biberons, il dort à l'heure où le suivant devrait être pris.
Il est constipé, les selles sont rares. Ceci est d'autant plus évocateur qu'il est nourri au
lait de mère. Cet enfant qui dort bèauroup est considéré comme « très sage ~~ parfois
22
« trop sage». Il ne manifeste que peu d'intérêt à ce qui l'entoure. La différence est
d'autant plus nette qu'il y a eu des enfants avant pour comparer la qualité de l'éveil.
v-
2. Les signes cliniques - Tableau 3
Ils sont importants à détecter le plus tôt possible.
•
L'ictère néonatal, jugé le plus souvent banal demeure bien plus longtemps Que
celui qui est appelé « physiologique» mais sa persistance est variable et il peut avoir
disparu lors du diagnostic.
•
Le cri est caractéristique: il est retardé dans son émission. L'enfant grimace
d'abord puis crie. Ce cri est rauque, bref, il ne dure que quelques secondes.
•
La respiration, dans les cas extrêmes. est brève. bruyante embarrassée en
décubitus dorsal. Les lèvres sont cyaniques, la déglutition aggrave la dyspnée.
•
L'enfant est très chevelu, sa chevelure néonatale ne tombe pas, les cheveux sont
secs et grossiers. Le visage est infiltré, particulièrement le nez, les arcades sourcilières,
les oreilles sont gonflées, la peau est froide (les mains bleutées ou violettes), marbrée,
sèche et desquame au niveau des pieds, des jambes, du dos et des épaules.
•
L' hernie ombilicale existe dans presque tous les cas. L'abdomen est distendu. L'enfant
est hypotonique, la tête ballote sur la nuque, le crâne présente une large fontanelle
antérieure et une fontanelle postérieure qui est anormalement perméable. Les sutures
crâniennes sont larges
•
La croissance pondérale est conservée et doit même être sujet d'étonnement car les
prises alimentaires ne sont pas en rapport. La croissance staturale est diminuée de
façon très marquée car elle est à comparer aux 4cm d'accroissement moyen lors du 1er
mOIs.
Le périmètre crânien se développe lentement lui aussi.
23
Tableau 3: PRINCIPAUX SIGNES CLINIQUES DE L'HYPOTHYROïDIE
CONGENITALE (6)
Période néonatale
: signes discrets voire absents
- Prolongation ictère néonatal
- Hypotonie axiale
- Fontanelle postérieure large
Premières semaÎnes de vie: Signes non spécifiques maÎs associés.
- Hypotonie axiale
- Difficultés il boire
- Macroglossie
- Constipation
- Ballonnement abdominal avec hernÎe
- Raucité du cri
- Enfant trop sage
En l'absence de traitement
- Insuffisance de croissance staturale
- Retard de l'âge osseux
- Retard psychomoteur
Tableau 4 : Normal pour les valeurs de T4 , T3 , d'après LAFRANCHI et TOUBLANC
(55)
HORMONES
T. Totale x
Ecart
T, Total x
Ecart
Cordon
102
19-130
0,45
0,15-0,75
1 - 3 jours
172
118-226
1,24
0,32-2,16
1 - 2 semaines
132
98 - 106
2.5
-
2 - 4 semaÎnes
111
70 - 155
1,6 - 2,40
1,60 - 2.40
1 - 4 mois
103
72 - 144
1,63
1,17 -2,09
4-12 mois
110
78 - 165
1.10-1,8
1,10-1,8
1
1
ng/m:
ng/m
Tableau 5' Normal pour les valeurs T4L, TBG et T8H (55),
HORMONES
T4 libre x
Ecart
TBGx
Ecart
TSH x
Ecart
18,5
12,9-32
5,6
-
9
< 2,5 -17,5
13,5 - 35
5
-
8
< 2,5 - 13,3
11,7-27
-
-
-
-
10 - 27
-
-
4
0,6 - 10
17,4
10 - 27
-
-
<2.4
2,5
15,2
10 - 24
4,4
3,1 - 5,6
2,1
0,6 - 6,3
21,6
1
19,6
16,5
1
1
pmol/l
mg/dl
mUI/1
25
VI- DIAGNOSTIC
VI-
1. DIAGNOSTIC ETIOLOGIQUE (6).
Il est basé sur le résultat de la cartographie thyroïdienne obtenue par
scintigraphie (à l'iode 123 ou au technétium ggm).
La cause de la dysgénésie
thyroïdienne (ectopie, athyréose) n'est pas connue. Le rôle d'anticorps bloquant la
croissance de la thyro·ide fœtale, d'origîne maternelle est· discuté. L'athyréose
s'accompagne de taux circulant très bas ou nul de thyroglobuline
VI- 2. DIAGNOSTIC DIFFERENTIEL (25, 38).
Dans les pays où le diagnostic clinique permet seul de reconnaître le
myxoedème. peu d'autres diagnostics sont envisageables: cardiopathie du fait des
troubles circulatoires de la cyanose périphénque et de lïnfiltration, trisomie 21 car
faciès dysmorphique, hypotonie et retard psychomoteur: mais. des associations des
deux conditions ne paraissent pas exceptionnelles voire une maladie osseuse ou une
mucopolysaccharidose. Le dosage systématique de la TSH et de la T, devant un
tableau clinique, même non évident, garde sont intérêt.
Tableau 6: Principales etiologies de l'hypothyroïde congénitale (6)
A- Périphérique (TSH 71)
Ectopie
Athyréose
Trouble de l'hormonosynlhèse transitoire du nouveau-né
Transition du nouveau-né
B- Centrale (TSH noomale n
:>lI
Insuffisance hypothalamo-hypophysaire
26
VII- TRAITEMENT (6)
II consiste en l'administration à vie de thyroxine. Celle-ci existe sous forme de
gouttes (L Thyroxine ®, une goutte = 51Jg) et de comprimés (levothyrox ®, un comprimé
= 25, 50, 75, 100 ou 150 IJg).
Les gouttes sont utilisées durant la première année de vie puis sont remplacées
ultérieurement par des comprimés. Le TTT est administré en une prise quotidiennE:.
La posologie est de 8 IJg/Kg/j durant le 1er trimestre de vie, puis les besoins
diminuent pour atteindre 5 IJg/Kg/j vers l'âge de 2 ans.
La surveillance se fait sur des données cliniques (évolution de la croissance
staturo-pondérale, fréquence cardiaque) et sur les taux circulant de T 4 et de TSH
(mensuel. puis tous les 2mois jusqu'à l'âge de 6 mois, trimestriel jusqu'à l'âge de 2 ans,
puis semestriel). La dose est à ajuster pour
ma.int~CJir
la T4 dans la zone limite
supérieure de la normale et la TSH détectable et < à 5mU/I. Il est essentiel que le
contrôle soit parfait, surtout la 1ère année de vie et ce, en raison du rôle des hormones
thyroidiennes dans le développement des structures osseuses. Durant cette période,
des ajustements fréquents de la dose sont nécessaires du fait des modifications rapides
du poids. Une hyposidermie est à rechercher et à corriger.
1
27
DEUXIEME PARTIE
ETUDE PERSONNELLE
l
MOYENS ET METHODES
28
29
1-
Sujets
Ce dépistage de l'hypothyroïdie néonatale a été initié par le laboratoire de
Biophysique médicale en collaboration avec le Centre Régional de dépistage néonatal
de Lille. Il a été effectué sur 522 nouveaux nés à la maternité de l'hôpital Abass Ndao
de Dakar entre décembre 1996 et Juillet 1997. Ce groupe comprend 236 garçons et
284 filles appartenant à loutes les ethnies du Sénégal.
11-
Matériels
11.1
Matériels de prélévement
Plateau
Coton
Alcool
Vaccinostyle
Papier buvard
schleicher - schuell
FIche d'identification
N° carnet de santé ..
Maternité
Nom et prénom de la mère
Adresse
Date de naissance
Poids de naissance
Prématuré:
OUI
Inon
Date de prélévement
N° d'identification
30
Il.2 Matériels de dosage
On utilise la trousse DELFIA h TSH qui contient des réactifs pour 960 dosages.
La date de péremption de la trousse complète est inscrite sur l'étiquette extérieur le
stockage se fait entre +2°C et 8°C.
11- 2.1. STANDARDS ET CONTROLES
Constituants
Quantité
Durée de vie et conservation
Standard h TSH
1 feuille de papier filtre
1~UI/ml de sang
(S&S 2992) contenant 5 séries péremption inscrite sur l'étiquette
~UI/m'
10
de sang
de tàches de sang séché
+2°C à 8°C
jusqu'à la date de
s'assurer que
l'enveloppe
25~
UI/ml de sang
plastique reste bien fermé
50~
UI/ml de sang
pendant la conservation
1OO~ Ullml de sang
250~
UI/ml de sang
Contrôles
1 feuille de papier filtre
+2°C à8°C jusqu'à la date
(valeurs approximatives (S&S 2992) contenant 5 séries de péremption inscrite sur
15~Ul/ml
de sang
60~Ul/ml
de sang
de tâches de sang séché
l'étiquelle.
S'assurer que l'enveloppe en
(voir les valeurs
plastique reste bien fermée
exactes sur l'étiquette
pendant la conservation
du sachet)
Les standards et les contrôles ont été préparés à partir de sang humain avec
hématocrite de 50-55% et calibrés contre la Seconde Préparation Internationale de
Référence ( IRP") (80/558) de l'OMS TSH humaine pour les immunodosages.
en
31
Il 2.2
REACTIFS
Constituants
Quantité
Durée de vie et conservation
Solution mère de
1 flacon de 1,5 ml
+2°C a +soC jusqu'a la date
Traceur Anti-hTSH -EL
de péremption inscrite sur
(-20~g/ml)
l'étiquette du flacon
(monoclonal
Contient des IgG de souris
de souris)
0,05% d'azide de sodium
E;:[
comme conservateur
Solution de lavage
1 bouteille de 250 ml
-
+2°C a +Boc jusqu'a la date
de péremption inscrite sur
concentrée
l'étiquette du Oacon
Solution saline concentrée 25 fois tamponnée Tris -Hel
(pH 7,B), contenant du Tween 20,
Contient du Germalill comme conservateur
+2°C aBoC jusqu'a la date
1 bouteille de 250 ml
1
1
Solution tampon
1
hTSH- -Néonatale
1prête il t'emploi
1
de péremption inscrite sur
; l'étiquette du flacon
.
Solution saline tamponnée Tris-HCI ( pH7,B) contenant de la
sérum albumine bovine, de la globuline bovine du Tween
40, du polyéthylène glycol 6000, un colorant rouge inerte, et
0,05 % d'azide de sodium comme conservateur.
Solution
1 bouteille de 250 ml
développement
+2°C à +8°C jusqu'à la date
de péremption inscrite sur
l'étiquette du flacon
Prête à l'emploi
Protéger de la lumière directe.
Solution de développement contenant du Triton X-10O"
de l'acide acétique et des chélateurs.
°
Barrettes de puits de
1 plaques x B x 12 puits
+2°C a +Boc jusqu'a la date
Microtitration
revêtus avec des anticorps
de péremption inscrite sur
anti- hTSH
dirigés contre un site
l'étiquette.
spécifique de la sous -unité f1 S'assurer que l'enveloppe
de la molécule hTSH ,
le plastique reste bien fermée.
1
32
11.2.3 Matériel indispensable non fourni avec trousse.
•
Fluorimètre en temps résolu
•
Laveur automatique
•
Agitateur automatique
•
Emporte-pièce automatique ou un emporte-pièce manuel pour découper les
disques de papier-filtre d'un diamètre d'environs 3 mm
•
Une pipette pour distribuer la solution diluée de traceur-Eppendorf Multipette
avec Combilips de Sml.
•
Pipettes de précision pour distribuer les volumes en microlitres
•
Pipettes graduées en millilitre de tampon pour préparer la solution diluée du
traceur
•
Eau distillée.
111- METHODE
111- 1. Calendrier
Les prélèvements ont été effectués avant la sortie de l'enfant de la maternité.
111.2.
•
Technique
Compléter soigneusement les informations concernant l'identification du
nouveau-né;
•
Réchauffer le talon;
•
Nettoyer le talon à l'alcool et laisser sécher;
•
Piquer franchement avec la lancette sur la face interne du talon
•
Remplir entiérement de sang, sans surcharge les cercles du papier buvard.
Lorsque le prélèvement est correct, les tâches de sang doivent apparaître
identtques des deux côtés du papier buvard.
•
Laisser sécher à température ambiante.
33
111.3 Dosage
111.3. 1. Principe du dosage
La méthode Deifia hTSH - néonatale est un dosage immuno-fluorimétrique
deux-siles sur phase solide fondée sur le principe du « sandwich
deux
anticorps
monoclonaux
(provenant
de
souris)
sont
»)
direct dans lequel
dirigés
contre
deux
déterminants antîgéniques distincts de la molécule d'hTSH.
Les échantillons contenant l'hTSH vont réagir simultanément avec les anticorps
monoclonaux immobilisés dirigés contre un site antigénique spécifique de la sous-unité
f1 d'hTSH et avec les anticorps monoclonaux marqués â l'europium (dirigés contre un
site antigénque différent localisé en partie sous la sous-unité r., et en partie sur la SQUS-
unité alpha). La solution de développement dissocie les ions europium de l'anticorps
marqué, qui forment alors des chélates hautement fluorescents avec les composantes
de la solution de développement
La fluorescence de chaque échantillon et
proportionnelle à la concentration de hTSH dans j'échantillon.
- Limite de détection = 2
~Ullml
(valeur moyenne standard 1 ~Ul/ml + 2 DS).
- Réactivité croisée
La réactivité croisée de la trousse Deifia hTSH néonatale avec les autres
hormones est présentée ci- après.
CONCENTRATION
HORMONE
CONCENTRATION AJOUTEE
EN Htsh APPARENTE
MESUREE
hLH
250 UI/I
<2
~Ul/ml
hFSH
250 UI/I
<2
~Ul/ml
hHCG
100.000 UI/I
<2
~Ullml
1lI- 3,2, ETAPE PRE-ANALYTIQUE
fi 1- 3. 2. 1. Vérification des papiers
On s'assure que les papiers soient correctement Imprégnés recto et verso.
111- 3, 2, 2, Préparation des réactifs
•
Vérifier la dale de p4remplion du coffret.
•
Remettre
a la température amiante (20-25 OC) au minimum 30
minutes avant
utilisation
•
Préparer les réactifs au minimum une heure avant leur utilisation.
•
Vérifier les niveaux de concentration des caljbrants et contrôler les fournis
dans chaque coffret.
Préparation des réactifs
Stabilité après reconstitution
Solution de lavage
2 semaines à +2"C - +25"C
Verser 100 ml de solution de lavage concentrée
dans un récipient fermé
,
,
dans un récipient propre el diluer par addition
1
de 2400 ml d'eau distillée
Traceur anti hTSH-Eu
Cette solution doit être diluée
Préparer au maximum une
a la concentration
j
heure avant utilisation
désirée ( voir table), Il est imortant que le
tampon ne vienne pas en contact avec la solution
mère de traceur, destinée à une utilisation ultérieure.
Nous conseillons j'emploi d'un récipient en
plastique jetable pour préparer la dilution de traceur.
Barrettes de microtitration
Laver chaque bande avec le
Transférer le nombre nécessaire de barrettes de
laveur automatique DEL FIA
Microtitration sur le support. ( Replacer les
Platewash en utilisant le
Barrettes restaf'"ltes d,ms l'emballage en plastique
programme 47 (prewash).
et refermer)
Ne laver que le nombre de
barrettes pouvant être
facilement utilisées dans les 30mn.
1
35
111- 3.3. ETAPE ANALYTIQUE.
111- 3. 3. 1. Positionnement des tubes.
Effectuer chaque détermination en double pour les standards et les contrôles.
Une courbe standard doit être établie
a chaque série (4 plaques maximum).
Placer en début de série les test à vérifier, les réponses aux demandes de
contrôle (en double).
111- 3. 3. 2. Introduction des échantillons
Découper l'emporte pièce des disques de 3 mm dans des barrettes sèches, puis
M
transférer par retournement dans les barrettes d'analyse lavées.
4
5
6
7
8
9
10
11
12
10
10
25
25
50
50
100
100
250
250
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
D
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH IECH
ECH
ECH
E
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
F
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
G
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
H
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
ECH
Cl
C2
1
2
3
A
1
1
B
ECH
C
1
Si plus d'une plaque est nécessaire, les suivantes comprennent les contrôles C1
et C2 et une gamme toutes les séries de 4 plaques.
111- 3. 3. 3. Réalisation du dosage
- Ajouter 200~1 de solution de traceur diluée anti-hT5H-Eu dans chaque puits en
employant la pipette Eppendorf multipette aprês avoir éliminé la premiêre aliquote.
Eviter toute la contamination en maintenant l'embout de la pipette légèrement au-
36
dessus du puits sans le toucher, et la vider sans loucher la bande de puits en plastique
ou la surface du liquide.
- Agiter rapidement pendant 10 minutes et incuber pendant 4 heures à température
ambiante sous agitation lente. L'incubation commence lorsque le dernier support est
préparé et a été agité pendant 10 minutes.
ATTENTION: Chaque série (1 à 4 plaques avec sa gamme étalon) doit élre agitée
sur le même agitateur.
Après l'agitation rapide de 10 minutes, on peul également recouvrir le support avec
une bande protectrice de laisser incuber toute une nuit au réfrigérateur (+2°C à + BOC )
sans agiter, puis incuber une heure supplémentaire El température ambiantes sous
agitation lente.
- Après incubation, retirer la solution et les disques de
papier~fillre des
puits
a l'aides d'une
pipette Pasteur connectée à une source de vide.
- Aspirer et laver chaque bande avec un laveur automatique DELFIA Platewash en
utilisant la programme 47 (wash ) : 6 cycles de lavage.
- Ajouter dans chaque puits
200~1
de solution de développement directement à partir de
sa bouteille en utilisant la pipette Eppendori Multipette recommandée après avoir rincé
le Combitip une fois avec la solution de développement. Remplir à nouveau le Combitip
et éliminer la première aliquote. Eviter de toucher les parois des puits ou leur contenu.
- Agiter lentement le support pendant 5 minutes
- Mesurer la fluorescence dans l'heure.
J7
Protocole normal
Protocole court
200~L de
Iraceur
couvrir (parafllm)
Agitation ({ rapide » 1Omn à température ambiante
Agitation lente 4 heures à température
18 heures à +4"C
ambiante
Agitation lente 1 heure à
Temrérature ambiante
6 lavages
200~1
de solution de développement
Agitation lente 5 mn
Lecture dans l'heure qui suit
III· 3. 4. DETECTION FINALE
Sélectionner le programme 47 pour une mesure automatique et les calculs des
résultats. Vérifier les paramètres du programme 47 et créer un nouveau programme s'il
diffère du programme suivant:
N" DE LA TROUSSE.
47 hTSH NEONATALE
TYPE DE DOSAGE.
IFMA
METHODE DE CALCUL.
SPLINE LISSE
AXEDESX.
LINEAIRE
AXE DES Y.
LINEAIRE
BLANCS.
o
STANDARDS.
6
REPETITION DES STANDARD.
2
CONCENTRATION DU STANDARD.
1,00
CONCENTRATION DU STANDARD.
10,00
CONCENTRATION DU STANDARD.
25,00
CONCENTRATION DU STANDARD.
50,00
CONCENTRATION DU STANDAPD •
100,0
CONCENTRATION DU STANDARD.
250,0
REPETITION DES ECHANTILLONS.
1
J8
REMARQUES IMPORTANTES
1- les réactifs fournis avec chaque trousse forment une unité. Ne pas mélanger des
réactifs provenant de trousse de lots différents. Ne pas utiliser les réactifs dont la
date de péremption est dépassée.
2- Avant leur utilisation, les réactif doivent être
a la
température ambiante (+20°C·
+25°C)
3- Lors du lavage des barrettes, on doit s'assurer que chaque puits est totalement
rempli. A la fin de ce lavage, il faut vérifier que les puits sont secs. Oans (e cas
d'humidité résiduelle retournez et tapez fermement sur du papier absorbant.
4- Le système d'aspiration/lavage ne doit pas être laissé inutilisé pendant trop
longtemps lorsqu'jl contient de la solution de lavage, car les aiguilles risquent de se
boucher et donc de provoquer de mauvaises distributions et aspirations. A la fin de
chaque journée de travail, aspirer de l'eau distillée dans le système aspirationllavage.
Rincer réguliérement avec une solution de NaCI (30gIL) puis avec de l'eau distillée et
de l'éthanol à 50% et finalement de l'eau distillée.
5- Afin d'éviter une contamination par l'Europium et par conséquence un bruit de fond
important de la fluorescence, il est nécessaire d'avoir de bonnes techniques de
pipettage et de lavage. C'est pourquoi il est extrêmement important d'utiliser les
pipettes fournies avec le système DELFIA dans les seules indications précisées.
6- La solution de développement doit être distribuée en utilisant exclusivement la
pipette Eppendorf Multipette recommandée aprés avoir rincé le combitip avec la
solution de développement conformément au mode d'emploi. Le même comtbitip ne
doit pas être utilisé pour les autres réactifs. Après utilisation replacer la pipette à sa
place scr le portoir en gardant le combitip toujours adapté.
39
Tableau 7: Valeur de dilution de la solution mère de Iraceur : anti-hTSH-Eu
nb
nb
Volume de
Volume de
nb
Plaque
Barrette
Tampon neoh
Tampon Neoh
Plaque
TSH (ml)
TSH (ml)
20
40
3
65
9
1
1
,.
,
4
6
70
90
110
15
18
7
130
21
8
140
160
180
200
23
26
29
32
34
37
39
41
43
45
48
51
,
2
9
10
Il
12
13
f'
1:'
3
16
1i
18
1°
,0
:1
"
--
]3
24
4
2:'
26
17
,8
29
30
31
32
5
55
--
::::
"
:';'
36
37
38
,.-0
40
210
130
2..tO
260
270
2S-0
300
320
330
350
370
380
400
410
430
440
460
470
490
500
520
530
550
560
570
590
600
620
630
.
7
8
,-,
9
71
74
76
79
81
84
86
89
90
92
95
97
100
102
Volume de
tampon Neoh
de lfaceur (Ill) TSH (ml)
6
11.5
56
59
61
64
66
69
Volume de la
solution
mère
Barrette
nb
10
41
42
43
44
45
46
47
48
49
50
51
760
780
790
810
52
830
53
54
55
56
57
57
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
840
850
860
880
890
910
77
78
79
80
104
107
110
112
115
117
120
122
125
127
650
670
700
720
730
750
930
940
950
970
990
1000
1020
1040
1060
1080
1100
1120
1130
1140
1150
1160
1180
1200
1220
1230
1250
1270
130
1"
1-",
137
,.
139
-
142
144
147
150
152
154
157
160
162
164
167
169
172
175
178
179
182
184
186
189
192
195
197
200
203
40
RESULTATS
41
1- Profil du Calendrier de Prélèvement
.~
Jours
JO
J1
J2
J 3
~~:
"..EFFEcTlf ,J
432
86
3
1
Tableau 8: Effectif des prélèvements
en foncl;on du jour
EFFECTIF
500
450
400
350
300
EFFEC!JFI
250
200
150
100
50·
0
L
JO
J1
J2
J3
Figure 9 : Effectif des prélèvements en fonction des jours.
42
11- Profil de Distribution selon le sexe.
Garçon
TOTAL
Pourcentage 54.40% 45,60°,10
100%
Sexe
1:
Fille
Tableau 9 : Pourcentage de répartition .
selon le sexe
Profil de distribution selon les
sexes
56,00%
54,00% +--~r0~~]-------j
Cl,)
52,00% +---1: t:r);~il---:...----1
Cl
.::g 50,00%
i---[L""...'-=,':+j\j-----
~
48,00%
+---nn'm:l~Hl
46,00%
a. 44,00%
l=jn~tll~j
...
i5
42,00%
••[=~
Fille
Garçon
+--'---I:~:;
40,00% -t---....s....;,;"--'----Sexe
figure 10: Pourcentage de répartition selon le sexe.
43
111-
CONTROLE DE QUALITE DES PRELEVEMENTS
Prélèvement
Accepté
Rejeté
TOTAL
Effectif
502
20
522
Tableau 10 : Résultat des contrôles de qualité
CAUSES
Rejet
SURCHARGE
INSUFFISANT
TOTAL
3
17
20
Tableau 11 : Causes de rejet
Sur les 522 prélèvements. 20 ont été rejetés pour surcharge et prélévement
insuffisant. De ce fait 502 prélèvements constituent l'èchantillon analysé.
IV-
DOSAGE
L'analyse des 502 patients a donné 'les résultats suivants:
Taux TSHIJUl/ml
0-20
20-50
> 50
Effectif
494
8
0
Prélévement
négatif positif positif
Tableau 12 : Résultats du dosage.
Un prélèvement est dît positif si le taux de TSH est supérieur ou égal à
20
~UI/mI.Les
enfants dont la TS.H. est <
Ceux dont la T.S.H est> 50
~UI/ml
20~Ul/ml
sont considérés comme normaux.
sont potentiellement porteurs d'une anomalie
thyroïdienne et seront donc convoqués pour une étude plus précise de leur fonction
thyroïdienne.
Chez les enfants dont la T.S.H. est située entre 20 et 50
~UI/ml,
un deuxième
prélèvement de contrôle sera demandé; et si la T. S. H. reste encore anormale, un
examen plus approfondi est envisagé.
45
Jours
J. 1
J. 0
J. 2
1
1
1
;
Moyenne
:
1
1
-X
J. 3
1
7,13
4,45
1
2,58
1
1,23
(J-IUI/ml)
1
1
1
3,83
1
3,17
1
-
2,12
Ecart type
1
1
1
Tableau 13 : Moyenne et écart type du taux de TSH des sujets négatifs en
fonction du jour du prélèvement.
46
Enfant
W1
N° 2
W3
W4
W5
Jour
J.
J.
J
J. 2
J
sexe
0
F
0
F
1
G
0
W6
J
1
W7
wa
J.
J.
0
0
F
G
F
F
G
20,6
22,5
26,3
30,1
26,9
,
1
Taux
de
T.S.H.
en
25,2
21,2
26
1
1
1
IJUllml
1
1
Tableau 14: Valeur des résultats positifs
Tous ces enfants positifs ont un taux de T.S.H. < 50 IJUllml.
Leur cas ne
nécessite donc qu'un deuxième prélèvement pour confirmer ou infirmer le diagnostic.
47
V-
CONTROLE DES VALEURS POSITIVES
Sur les huit (8) prélèvements que nous avons trouvé positifs, seuls six (6) ont
été retrouvés et ont pu bénéficier d'un contrôle et les deux ont été perdus de vue.
Tous les résultats contrôlés se retrouvent dans la zone basse avec un taux de
T.S.H. < 20
~Ul/ml.
Il n'y a donc pas de cas d'hypothyroïdie sur ces six (6) patients.
Ce sont des faux positifs.
On appelle faux positif tout enfant suspecté de la maladie et dont /83 contrôles
infirment le diagnostic.
Enfant
W1
N°2
N° 3
N°S
N° 7
N° 8
0,58
1,29
0,91
2,11
3,27
16
1
1
Taux de
T,S,H, en
~Ullml
Tableau 15 : Résultats du contrôle des valeurs positives
COMMENTAIRE
Il Y a environ 20 ans que les pédiatres se sont dotés d'un outil nouveau pour
diagnostiquer
et
traiter
précocement
les
enfants
atteints
d'anomalie
du
développement de la glande thyroïde entraînant une hypothyroïdie.
Ce dépistage précoce a considérablement modifié le pronostic de cette
affection dans les pays développés contrairement aux pays sous développés, plus
particulièrement au Sénégal. Dans les pays développés comme la France, le taux de
couverture est de 99,5% (56).
Dans les pays sous développés, à l'exception de certains pays comme l'Inde,
la Turquie, ou l'Arabie Saoudite. il n'existe pas de programme de dépistage néonatal.
Un diagnostic clinique précoce d'hypothyroïdie congénitale est rarement fait et
d'ailleurs, rarement faisable. Le diagnostic est souvent difficile et l'on y pense
rarement sauf s'il existe une hypothyroïdie dans la famille. ou si la mère a présenté
des troubles thyroïdiens au cours de la grossesse. D'après Letarte J. (34), moins de
3 % des enfants dépistés ont été diagnostiqués com.r!le hypothyroïdiens ~rrace à la
présence de signes cliniques.
Au Sénégal, une étude préliminaire sur l'exploration thyroïdienne chez
l'enfant, faite par Ndour Mbaye Soukar (36) sur 105 enfants âgés de 5 jours à 15
ans, a permis de recenser 15 enfants (22 %) hypothyroïdiens regroupant 9 filles et 6
garçons.
Pour l'ensemble de ces enfants hypothyroïdiens, l'établissement du diagnostic
s'est avéré tardif (1 an).
1. PRELEVEMENT
Dans les pays sous développés et plus particulièrement au Sénégal, pour des
raisons socio-économiques, les femmes sont dans l'obligation de quitter la maternité
le plus tôt possible. Et il est toujours difficile de les reconvoquer pour une analyse
dont elles ne voient pas toujours l'importance. C'est pourquoi 518 prélèvements
(99,24 %) ont été effectués entre le 1er et le 2 ème jour. La précocité du prélèvement
assure un taux de couverture maximale.
50
Cependant la précocité des prélèvements risque de collecter des échantillons
dont la TSH plasmatique serait supérieure il
20~Ul/ml
en dehors de toute pathologie
thyroidienne; puisque la crise hypothalamo-hypophyso-thyroïdlenne a lieu il la
naissance et le retour à la situation d'équilibre se fait dans la première semaine après
la naissance (54). Cette situation peut être responsable d'un nombre relativement
important de faux positifs. Dans notre étude le pourcentage de faux positifs est de
1,2%.
Par contre en Europe le dépistage de l'hypothyroïdie qui s'effectue au Se jour
donne un taux de faux positifs de 0,15% (51).
2. Contrôle de qualité
20 prélèvements sur 522 (3.8%) ont été rejetés pour surcharge ou prélèvement
insuffisant
La quasi totalité des rejets concernaient les prélèvements effectués lors des deux
premiers mois. La non maîtrise des techniques de prélèvement en est la principale
cause.
Le prélèvement a lieu au talon nettoyé à l'alcool, il est recueilli sur du papier où le
dépôt de sang doit réaliser une tâche de 13mm sur des cercles pré-dessinés; la
quantité de sang qui traverse le papier correspond à
50~1
de sang; une pastille
centrale de 5mm prélevée à l'emporte-pièce permet alors un dosage sur 111-11/1 de
sang.
C'est la raison pour laquelle lout dépistage de l'hypothyroïdie néonatale
nécessite au préalable une formation du personnel.
3. Bilan critique du dépistage
Le dépistage systématique de l'H.C. a été introduit afin d'éviter la survenue
d'une arriération mentale chez les enfants hypothyroïdiens. Il n'y a aucun doute
51
Il n'y a aucun doute quant à l'efficacité d'un traitement précoce si un dépistage,
systémalique est réalisé (29).
e
En effet pour un traitement débutant au-delà de la 6 semaine de vie, le quotient ""
intellectuel n'est supérieur ou égal à gO que dans 38% des cas (perelman R. 41).
L'incidence de la maladie calculée maintenant sur plusieurs années est de
l'ordre de 1/4000 en France. Ce chiffre est trés proche des résultats publiés par
différents pays d'Europe (13).
En Arabie Saoudite, elle est de 1/3450 (1) et 1/4207 en Inde (15).
Cette incidence est inconnue dans les pays où il n'existe pas de dépistage
systématique.
Une étude faite par Boulacger Nathalie Ndiaye (5), Indique que l'Incidence de
l'hypothyroïdie néonatale est liée à la sévérité de la carence en iode. Dans les zones
de forte carence en iode, l'hypolhyroidie néonatale peut toucher jusqu'à 10% des
nouveau-nés.
Au Sénégal, 33% de la population est exposée aux Troubles Dus à la Carence
en Iode (TDCI) notamment dans les régions de Kolda et Tambacounda.
Cette information peut être déterminante dans la prise de conscience par les
autorités de l'importance de la mise en place d'un dépistage précoce de l'H.C., ne
serait- ce que dans les zones à forte carence en iode.
4. Autre approche méthodologique.
Le dépistage de la maladie utilisant le dosage de T 4
a été réalisé dans
certains pays (Inde) (15). Cette méthode permet de dépister les malades atteints
d'hypothyroïdie d'origine haute. Elle a comme inconvénient de nécessiter un taux de
rappel irnportant pour assurer sa sécurité. Ce taux se situe probablement autour de
2%, soit 10 fois plus que le dépistage de la T.S.H.
CONCLUSION
53
L'Hypothyroïdie Congénitale était l'une des causes méconnues de retard mental
chez les enfants jusqu'au moment où les techniques de dépistage ont permis la mise
sous thérapie substitutive précoce des nourrissons affectés.
En effet, l'amélioration des techniques de dosage radio-immunoJogiques et
immunofluorométriques des hormones thyroïdiennes a su résoudre la quasi-totalité des
problémes pratiques que posaient l'H.C.
Son incidence est liée à la sévérité de la carence en iode. Au Sénégal, prés du
1/3 de la population est exposé aux troubles dus à )a carence en Iode.
Il
nous
est
alors
apparu
opportun
d'initier
le
dépistage
néonatal
de
l'hypothyro'ldide de 502 nouveau-nés à la maternité de l'hôpital Abass NDAO en
collaboration avec le Centre Régional de Dépistage Néonatal de Lille (France).
Deux profils de nouveau-nés ont été individualises.
ceux ayant une TSH <
20~Ul/ml,
494 nouveau-nés (98,4%) sont
concernés. Ils sont considérés comme normaux.
Ceux ayant une TSH
> 20~Ul/ml.
garçons sont concernés.
8 nouveau-nés (1,6) dont 5 filles et 3
Chez 6
de ces
nouveau-nés,
un 2
e
prélèvement a été demandé. La TSH était revenue à fa normale. Ce
groupe comprenait 3 filles et 3 garçons. Ces enfants suspectés de la
maladie et dont les contrôles infirment le diagnostic sont appelés faux
positifs. Les deux autres enfants n'ont pas pu être retrouvés_
Pour assurer un meilleur taux de couverture l'âge du dépistage a été avancé aux
2 premiers jours de la vie contrairement aux pays développés où l'on pratique le
dépistage le Se jour pour deux raisons essentielles: la première est que le dépistage de
l'hypothyroïdie s'est greffé sur celui de la phénylcétonurie. Ensuite, il fallait dans une
certaine mesure se situer à distance de la crise hypothalamo-hypophyso-thyroïdienne
ère
qui a lieu à la naissance et dont le retour à la situation d'équilibre se fait dans la 1
sem~ine
aprés la naissance (56).
Ceci nous expose à une collecte d'échantillons dont la TSH plasmatique serait
supérieure ~ 2C~Ul/ml en dehors de toute pathologie thyroïdienne.
54
La Thyroïde du nouveau-né est beaucoup plus sensible à la déficience iodée du
fait de ses faibles réserves en iode. Elles dépendent entièrement de la manière dont les
besoins de la mère ont été couverts. C'est pourquoi le dépistage de l'hypothyroïdie
néonatale est un indice très sensible pour apprécier l'importance de la carence en iode
et détecter la présence de facteurs goitrigénes dans l'environnement (Delange F. (14)).
L'existence d'un programme national de lutte contre les TOCI devrait inciter les
décideurs à adopter une politique permettant de prévenir et traiter précocement
l'hypothyroïdie néonôtale surtout dans les zones il forte carence en iode notamment
dans les régions de Kolda et Tambacounda.
Au terme de cette étude, il apparail que l'instauration d'un dépistage ciblé de
l'hypothyroïdie néonatale s'avère essentielle au Sénégal, et aujourd'hui plus que jamais,
nous devons sensibiliser le personnel médical sur l'hypothyroïdie et développer une
collaboration plus étroite entre le clinicien, le biologiste et le technicien pour l'obtention
du diagnostic le plus précis et le plus précoce possible.
BIBLIOGRAPHIE
1.
AI Jurayyan NA
Congenital Hypothyroidism: Increased incidence in Najran province,
Saudi Arabia.
J. Trop Pédiatr. 1996; 42 (6); 348 - 51
2.
Association Française pour le Dépistage et la Prévention
des maladies métaboliques et des handicaps de l'enfant.
Dépistage néonatal de la phénylcétonurie et l'hypothyroldie en
France. Statistique 1985
Arch. Fr Ped; 1987 44(1).749-752.
3.
Bellisario R. et Coll
Identification and characterization of two groups of congenital
hypothyrc',d infants Implications for new-born screening
Early. HL'n. Dev, 1997, 47 (2): 225-245
4.
Black E. G.
Serum Thyroglobulin in normal and hypothyroid new-born
J. Clin Endocrinol, 1982, 16,267-274
5.
Boulanger Nathalie NDIAYE
les troubles dus à la carence en iode en Afrique.
Thése, Médecine, Dakar, 1994, N° 64
6.
Brauner R. et Fontoura M.
Pathologie de la glande thyrolde chez l'enfant.
Editions techniques, Enc, Pédiatrie, 4-105, A'D, 1995, 7 p.
7,
Brown AI
Racial differences in the incidence of congenital hypothyroïdism,
J. Pediatr; 1981, 99, 934-936.
8.
Buist N. R. M., Murphy' W. F., Brandon G. R. et al.
Se:ni automated enzyme immuno assay of thyrotropin as a mass
screening test for neonatal hypothyroidism
lancet 1975; ~: 872- 372
1
9.
Cha puis Y.
Anatomie du Corps Thyroïde
Enc. Paris. 10.002. A-1 O. 4-5-10
10. Chevrel J. P. et coll
Anatomie Générale
Paris. Masson. 1985. 195 P
11. Connelley J. H., Francis 1., Robertson E. F. et AI
Neonatal Thyroïd Screening, Raven press. New York, 1980; 145p.
12. Curling T. B.
Elaboration of thyroglobulin in the thyroid follicule
Med. chir Trans 1850; 33 303
13. CZERNICHOW R.
Plasma thyroglobulin measurements help to determine the
type of thyroid defect in congenital hypothyroidism
J. clin. Endocr. metab. 1983, 56, 242-245.
14. Derange F.
Nutrition Iodée et Hypothyroïdie Néonatale
Rev. Med. Bruxelles, 1994, 15 (6).
15. Desaï M. P. et Coll
Neonatal screening for congenital hypothyroidism using the filter
paper thyroxin technique.
Indian J Med. Res 1994, 100 (7), 36-42
16. Dupouy J. P. et Coll
Hormones et Gran.des fonctions.
Paris, Marketing, 1992, 511 P
17. Dussault J. H., Laberge C.,
Goitrigens dietary in Idjwi Island
Clin Res. 1972; 20; 918.
18. Dussault J. H., Laberge C.,
Selection and interpretation of diagnostic tests'and procedures.
Union Med can: 1973; 102; 2062
,
19. Dussault J. H., Laberge C., Coulombe P, Laberge CV et al
TSH Measurements from blood spots on filter paper : A confirmatory
sreening test for neonatal hyperthyroidism.
J. Pediatr 1975; §§., 670-674.
20. Fisher D. A. et Coll
Early treatment of congenital hypothyroldism Pediatries, 1989, 83,
785-789.
21. Freake H. C. et coll
The regulation of lipogenesis by thyrold hormon and its contributions
to thermogenesis Endocrinol, 1989, 125, 2868-2874
22. Guillot M. et coll
Hypothyroïdie infantile chez un nourrisson; Intérêt et limites des tests
de dépistage néonatal par dosage de la TSH sur sang séché, Arch
F. Pediatrique, 1986. 43, 825-826.
23. Hahn - Hb Jr
Neonatal screening for congenital hypothyroldism in Texas
Tex- Med, 1997. 93 (3) ; 58-61.
24. Jacobsen B. B., Brandt N. J.,
Dépistage de l'hypothvroïdie néonatale: résultat d'une enquête
internationale.
Arch. Dis chi Id 1981; 56:134
25. Khale W. et Coll,
Atlas commenté d'Anatomie Humaine pour Etudiant et Praticien.
Paris, Science Medecine Flammarion, 1989, 212 P
26. Klein A. H., Meltzer 5., Kenny F. N.,
Thyroid function in neonatal hypothyroidism
J. Pediatr 1972; 81 : 912
27. Klein A. H., Augustin A. V., Foley T. P.
Neurological damage to the fœtus resulting from severe iodine
deficiency during pregnancy.
Lancet 1974; 2: 77
28. Lacombe M.
Précis d'Anatomie et de Physiologie Humaine.
Paris, Lamarre-Poinat, 1984, 182 p.
29. Larsson A.
Pourquoi la fréquence de l'hypothyroIdie congénitale a-t-elle doublé
depuis l'introduction de son dépistage systématique.
Arch. Fr Pediatr, 1987; 44; 677-9
30. Léger A.
Pathologie thyroldienne : Dg et lU, Paris, Médecine Science,
Flammarion, 1990.
31. Léger A
Structure et Physiologie Thyroidienne. Editions Technique, ENC,
Paris, Endocrinologie. Nutrition 10.000 2 BlO , 1991, 12p
32. Léger J. et Coll
Sécrétion of hormone by ectopie thyroId glands alter prolonged
thyroxin therapy, J. Pediatr 1990, 116, 111-114.
33. Lebecq M. F., Glorieux J., Fassiaux J. P., et al.
Le dépistage néonatal systématique de l'hypothyroIdie dix ans aprés.
Arch Fr. Pediatr 1990; 47 581-584
34. Leta rte J.
HypothyroIdie Congénitale: élément de pronostic et maturation
osseuse.
Arch for pediatr 1987, 44; 705-706.
35. Mbaye Aliou,
Bilan hormonal thyroldien du sujet âgé
Thése. Pharmacie, Dakar, 1996, W 45
36. Mbaye Soukar Ndour,
Apport du dosage radio-immunologique dans l'exploration
thyroIdienne chez l'enfant au CHU de Dakar
Thèse, Pharmacie, Dakar, 1994, W 99.
37. Means J.
The Thyroid and its deseases, 2,d ed.
Philadelphia, J B Lippin Cott, 1978, 192 P
38. Mornex R. et Coll,
Métabolisme des hormones thyroIdiennes et applications cliniques
Rev. Praticien, 1979, 29 (11), 979-988.
.
39. Murray G. R.,
Introduction à la connaissance de sa structure et de ses fonctions.
Br Med J. 1891; 2: 796
40. Osier N. ,
lodoprotein in the thyroid
Trans Congress Am physicians surg 1897; 1 : 195
41. Perelman R.,
Pediatrie pratique,
Perinatalogie, 1985,1,457-612.
42. Peter H. J. et Coll,
Autonomous growth but not autonomous function, in embryonic
human thyroïds: a clue to understanding autonomous goitres growth?
J. clin Endocrinol, 1988, 66, 968-975
43. Pezzins V. et coll
Serum thyroglobulin levels in the new-born;
J. clin Endoctrinol. Metab. 1981 -52,364-.366
.. '
44. Pierson M.
Hypothyroidie de j'enfant: in Endocrinologie Pediatrique et
Croissance Paris, Flammarion, 1981, 123-302
.'
45. Piolino V. et coll,
Thermogenic effect of thyroïd hormon: Interaction with epinephrine
and infusion. The Am. Physio. Society, 1990, E 305-E 311.
46. Poirier J. et Coll,
Abrégé d'Histologie. Paris, Masson, 1988, 267 P
47. Raiti 5., Newns G. A.,
The Thyroid and its desease,
Arch Dis Child 1971; 46 : 912
48. Robbins J. et coll,
lodoprotein in the thryroïd;
Ann. NY Acct: Sei, 1960, 86, 373-399.
49. Rochiccioli P., Dutang G., Bayard F., Augier D.
Blood spot Thyroxin-Binding-Globulin • A means to reduce recall rate
in a screening strategy for neonatal hypothyroidism.
Pediatr Res 1975; l). • 685.
50. Rochiccioli P. et Coll,
L'ectopie thyroldienne. cause d'erreur du dépistage néonatal de
l'hypothyroïdie.
Arch. Fr, Pediatr; 1986, 30, 797-800
51. Rochiccioli P.,
Le dépistage néonatal systématique de l'hypothyroldie 10 ans après.
Arch. Fr. Pèdiatrique, 1987, 44, 461-464.
52.
Sphel M. et Coll,
Neonatal echographic findings in congenital hypothyroïdsm.
Plenum Press Pubilshing ed; New York. 1989, pp 199-210.
53. Studer H. et coll,
Heterogeneity of thyrold cells • The basis for understanding thyroïd
function and nodular goiter growth,
Endocr. Rev. 1989, 10, 125-135.
54. Toublanc J. E.,
New Horizons in Neonatal Screening.
Amsterdam, Exerpta Medica, 1989.
55. Toublanc J. E. et coll,
Etude du développement psychomoteur et intellectuel dans 52 cas
d'hypothyroïdie dépistée à la naissance
Arch. Fr. Pediatr. 1990,47.191-195.
56. Toublanc J. E.
Hypothyroïdie de l'enfant.
Edition technique, EMC, Paris, Glandes endocrines; Nutrition, 10.005
A 'o , 12- 1990,10 p.
57. Young B.,
Elaboration of thyroglobulin in the thyroïd follicule.
Endocrinol. 1964, 74, 335-353
Je jure, en présence des maîtres de Faculté, des conseillers de J'Ordre des
Pharmaciens et de mes condisciples;
D'honorer ceux qui m'ont instruit dans les préceptes de mon art et de leur témoigner ma
reconnaissance en restant fidèle â leur enseignement;
D'exercer, dans l'intérêt de la santé publique, ma profession avec conscience et de
respecter non seulement la législation en vigueur, mais aussi les règles de J'honneur,
de la probité et du désintéressement;
De ne jamais oublier ma responsabilité et mes devoirs envers le malade et sa dignité
humaine.
En aucun cas, je ne consentirai â utIliser mes connaissances et mon état pour
corrompre les mœurs et favoriser des actes criminels.
Que les hommes m'accordent leur estime si je suis fidèle â mes promesses.
Que je sois couvert d'opprobre et méprisé de mes confrères si j'y manque.