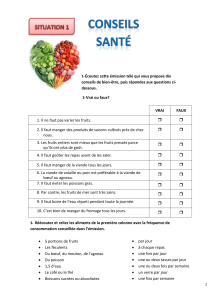
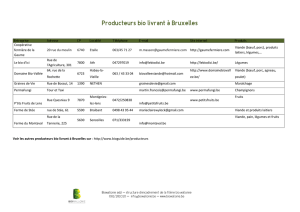
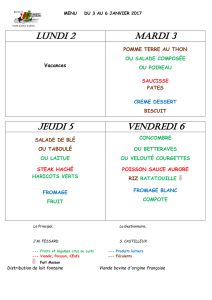
Thème Synthèse bibliographique sur l`organisation de tissu

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
U N I V E R S I T E K A S D I M E R B A H , O U A R G L A
F A C U L T E D E S S C I E N C E S D E L A N A T U R E E T D E L A V I E
D E P A R T E M E N T D E S S C I E N C E S B I O L O G I Q U E
P r o j e t d e F i n d ’ E t u d e s
E n v u e d e l ’ o b t e n t i o n d u d i p l ô m e d e
Licence
Domaine : Sciences de la nature et de la vie
Filière : Biologie
Spécialité : Biochimie fondamentale et appliquée
Thème
Synthèse bibliographique sur l’organisation de tissu
conjonctif et sa relation avec la texture et la tendreté de la
viande
Encadreur :Mme Benaissa Atika M.A. « B » Présenté par :
Examinateur :Mme SIBOUKEUR Amina M.A. « B » GHILANI Hayet
RAMDANE Sara
Année universitaire 2013/2014

Remerci
RemerciRemerci
Remercie
ee
ements
mentsments
ments
Avant tout, nous remercions Dieu tout puissant de nous avoir donné la
force,
le courage, la persistance et nous a permis d’exploiter les moyens disponibles
à
fin d’accomplir ce modeste travail. Merci de nous avoir éclairé le chemin de
la
réussite.
Nos vifs remerciements et notre profonde gratitude particulièrement à
Mme
B
BB
BE
EE
EN
NN
NA
AA
AI
II
IS
SS
SSA
SASA
SA
A
AA
At
tt
ti
ii
ik
kk
ka
aa
a
M.A.B au Département des Sciences Biologiques à
la
Faculté des Sciences de la Nature et de la Vie de l’Université Kasdi
Merbah
-
Ouargla, qui nous a
encadrées
Depuis les premiers instants, sa pédagogie, son dévouement, ses
précieux
conseils, ses encouragements, sa patience, sa disponibilité et sa gentillesse
ont
été importants pour nous et largement contribué à l’évolution de cette
étude.
Nous tenons à remercier profondément M
MM
Mm
mm
me
ee
e
S
SS
SI
II
IB
BB
BO
OO
OU
UU
UK
KK
KEU
EUEU
EUR
RR
R
A
AA
Am
mm
mina
inaina
ina
M.A.B
au Département des Sciences Biologiques à la Faculté des Sciences de
la
Nature et de la Vie de l’Université Kasdi Merbah-Ouargla, d’avoir
accepté
d’examiner ce
travail.
Nous tenons à exprimer nos sincères remerciements à tous les professeur
qui
nous ont enseigné et qui par leurs compétences nous ont soutenu dans
la
poursuite de nos
études.
Enfin, nous remercions également tous ceux qui nous ont
soutenus,
encouragés et rendus service au cours de la réalisation de ce
mémoire.
Merci à tous et à
toutes.

Dédicaces
Je dédie ce modeste travail
A celle qui ma éclairé le chemin de la vie, et ma comblé d’amour,
d’affection et d’encouragement pour que je devienne ce que je
suis aujourd’hui ; Ma mère.
Que Dieu la protège et lui donne longue vie.
A l’âme de mon père, école de mon enfance, qui avait toujours
souhaité ma réussite, que Dieu domicilé le paradis.
A mes chères frères Abdelhakim, Younes et Abbas qui mon
toujours soutenus et toujours étaient présent pour moi.
Aux épouses de mes frères Bahria, Sarah et Wafa.
A ma nièce Zina, et mes neveux Mohammed Salah et Wassim.
Ces petits anges qui nous comblent de joie.
A mon cher binôme Sara
A ma chère amie ; Maroua qui est toujours pré de moi.
A mes adorables amies ; Wiam, Chifa, Meriem, Bouthaïna,
Sabrinel, Wafa, Nassima, Sara, Mounira et Ichrak.
A toute la promotion de 3
ème
année Biochimie 2014.
A toute personne ayant contribué de prés ou de loin à la
réalisation de ce travail.
H
HH
Ha
aa
ay
yy
ye
ee
et
tt
t.
..
.

Dédicaces
Je dédie ce modeste
mémoire
A mes chers parents qui m'ont éclairé le chemin
de
la vie par leur grand soutien et
leurs
encouragements, par leur énormes sacrifices
qu'ils
m'ont consentis durant mes études et qui
ont
toujours aimé me voire
réussir
A celle qui m'a donné la vie, le symbole de
tendresse
Ma
mère
A mon père, qui a été mon ombre durant toutes
les
années des études, et qui a veillé tout au long de
ma
vie à m’encourager, à me donner l'aide et à
me
protéger.
Que Dieu les gardes et les
protèges.
A mon frère
Riad
A mes adorables sœurs Asma, Doha,
Hadjer
A ma chère
binôme
Hayet
A mes
amies
Sabrinel, Houda, Mebarka, Khaoula,
Hassna,
Nadjia, Yasmina
…
A toute la promotion de 3
ème
année biochimie
2014
A tous ceux qui me sont chères. A tous ceux
qui
m'aime
A tous ceux que
j'aime.
A Tous ceux qui m’ont connus, aimés
apprécies,
encouragés, aidés de prée ou loin pendant tous
mon
cursus.
S
SS
S
a
aa
ar
rr
ra
aa
a

Table des matières
Remerciements Listes
des tableaux Listes des
figures Listes des
abréviations
Introduction 1
Chapitre I- Transformation du muscle en viande.
I- Transformation du muscle en viande. 3
I-1- Définition de muscle. 3
I-2- Types des tissus. 3
I-2-1- Tissu musculaire. 3
I-2-2- Tissu conjonctif. 3
I-2-3- Tissu adipeux. 3
I-3- Composition du tissu. 4
I-4- Propriétés des muscle. 4
I-4-1- Contractilité. 4
I-4-2- Extensibilité. 4
I -4-3- Elasticité. 4
I-4-4- Excitabilité. 5
I-5- Différent types des muscles. 5
I-5-1- Muscle lisse. 5
I-5-2- Muscle intermédiaire. 6
I-5-3- Muscle striée. 6
I-6- Transformation du muscle en viande. 9
I-6-1- Modification des paramètres physico- chimiques. 9
I-6-2- Transformation enzymatiques. 9
I-6-3- Etapes de transformation. 9
I-6-3-1- Etat vivant. 9
I-6-3-2- Etat pantelant. 9
I-6-3-3- Rigidité cadavérique. 10
I-6-3-4- Maturation (état rassis). 10
Chapitre II – Généralités sur la Viande.
II - Généralités sur la viande. 12
II-1- Définition de viande. 12
II-2- Différentes types de viandes. 12
II-3- Composition de viande. 12
II-3-1- Composition biochimique. 12
II-3-1-1- Protéines. 12
II-3-1-2- Glucides. 13
II-3-1-3- Lipides. 13
II-3-1-4- Vitamines. 14
II-3-1-4-1- Vitamine A. 14
II-3-1-4-2- Vitamines B2 et B6. 14
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
1
/
58
100%