Partie I - Canalblog

1
Année :2007-2008 1ère Session
Licence UE SVI304 BIOCHIMIE
Durée : 90 min
Documents non autorisés,
Calculatrice de type Bordeaux I autorisée
Papier millimétré
Partie I :
1. METABOLISME (40pts)
L’aspirine (salicylate) inhibe entre autre un enzyme nommé « glutamate déshydrogénase ».
a) À l’aide des valeurs données ci-dessous, déterminez le Km et la Vmax ainsi que le type d’inhibition. (10/10/10p)
b) Vu le nom de l’enzyme, décrivez en deux lignes le type de réaction et lequel des cofacteurs est probablement impliqué :
ATP, Mg2+, NADH, Fe3+, Vitamine D ? (10p)
Produit par minute
(microgramme)
Substrat, mM sans salicylate
40 mM
salicylate
1.5 0.21 0.08
2.0 0.25 0.1
3.0 0.28 0.12
4.0 0.33 0.13
8.0 0.44 0.16
16.0 0.40 0.18
Les Km et le Vmax peuvent être déterminés soit par certains logiciels (dont vous ne disposez pas) soit de
manière graphique par le Blot de Lineweaver-Burke. Ceci a été mentionné à plusieurs reprises lors des cours
et des TD. Des valeurs obtenues par graph « simple » (« courbe ») ne sont pas prises en considération car
trop imprécis (0 points). Les valeurs obtenues (Km, Vmax) ont des unités ! (Km, mM ; Vmax, g/min) ; l’ absence
des unités entraîne une réduction de 2 pts.
Km : ca. 2,8 mM (des valeurs approximatives ont été reconnues comme juste si graph ok)
Vmax : 0.5 g/min; avec aspirine, 0.2 g/min (des valeurs approximatives ont été reconnu comme juste si
graph ok)
Les valeurs ont été tirées d’une publication récente dans le « Journal of Biological Chemistry » et une
solution s’impose : inhibition non-compétitive. Cependant, selon la qualité de votre graph, d’ autres
solutions ont été obtenues: soit une inhibition compétitive soit une inhibition mixte (du à des imprécisions de
votre graph) ou même in-compétitive. Les autres solutions ont aussi été reconnues pourvu que vous avez livré
un graph Lineweaver-Burke et que votre interprétation est cohérente avec vos graphs (En regardant les
valeurs, une inhibition compétitive semble malgré tout peu probable - trop de différences au niveau des Vmax - et la
mixte repose sur une mauvaise traçage de votre part).
Finalement quelques-uns de vous ont donné un minuscule schéma de graph de Lineweaver-Burke sans graph
sur papier millimétré. Naturellement ceci suggère fortement l’obtention d’information d’autre part et ne
peut pas être pris en compte
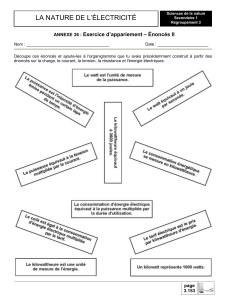
Non-compétitive Compétitive
S
S
I
S
I
I
S
I
1/V
1/[S]
1/Vmax
-
1/K
-
K
M
stable
1/
V
1/[S
]
1/V
ma
x
-
1/K
- Vmax =
- KM change
S
I
S
I

2
b) dehydrogenase = extraction d’électrons (non, pas de protons !), donc NADH
2. METABOLISME
Quels sont les enzymes clé de la glycolyse et quelles réactions catalysent-ils? (10 p)
Hexokinase, phosphofructokinase et pyruvate kinase (les réactions irréversibles)
Remarque : la question était claire, la description de toute la glycolyse SANS indiquer les enzymes clés ne répond
pas à la question.
3. HEMOGLOBINE
L’hormone thyroïdien thyroxine (T3) induit l’augmentation du taux d’une enzyme, la 2,3 BPG synthase, nécessaire à la
synthèse de 2,3 BPG.
a) Quel est l’effet d’une déficience en T3 au niveau de l’adaptation à l’altitude ? (10p)
b) Est-ce que cet effet du T3 risque d’influencer le transfert foeto-maternel d’oxygène ? (10p)
a) moins de 2,3 BPG disponible ; adaptation altitude implique augmentation 2,3 BPG afin de mettre le
Hb en état T (moins d’affinité pour O2 surtout au niveau tissulaire, meilleure extraction d’O2). Donc
ici manque de 2,3 BPG, pas d’augmentation d’extraction tissulaire nécessaire pour l’adaptation.
Conclusion : l’adaptation sera moins bonne, fatigue musculaire.
b) Ce cas est un peu construit et le manque de T3 entraîne surtout de défaut cérébral. Le Hb fœtale ne
dépend que peu du 2,3 BPG (voir diapo polycopié !), dont l’effet de diminution de 2,3 BPG sera
surtout au niveau du Hb maternel (que possédera une affinité accrue) avec conséquence de
diminution d’extraction d’oxygène car diminution des affinités relatives entre Hb maternel et HbF.
Conclusion : transfert affecté par diminution de la différence d’affinité suite à la prépondérance de
l’état R au niveau de l’Hb maternel.
4. PROTEINES
Les endorphines (de « morphine » et « endogène ») sont des neurotransmetteurs agissant sur les récepteurs opiacés. Les
premières endorphines ont été découvertes par John Hughes et Hans Kosterlitz dans le cerveau d'un cochon dans les années
1970. Ils sont peut-être, entre autre, responsables de la sensation agréable des coureurs (« runners high »).
Les endorphines sont entre autre présent sous forme de pentapeptide : Tyr-Phe-Gly-Gly-Leu.
a. Ecrivez la formule développée de ce peptide (10p)
b. Donnez sa charge à pH 2,7 et 10. (5p)
c. Est-ce qu’une mutation de Leu en Met change la solubilité ? (5p)
a) regardez svp dans le polycopié ; attention aux liaisons peptidiques (la simple présentation d’acides
aminés au lieu du peptide n’a pas été retenue)
b) # à pH 2.7, l’amino-terminus est sous forme NH3
+ (donc charge +1) la majorité du carboxy-terminus
sous forme COOH (pKa 2.2 donc charge ca; -0.5) et le –OH du tyrosine est sous forme OH ; donc
charge +1 ou +0.5 (0.5 plus correcte ; les 2 réponses ont été retenues)
# à pH 10, l’amino-terminus est sous forme NH2, le carboxy-terminus sous forme COO- et le –OH du
tyrosine est en moitié sous forme O- et en moitié sous forme OH (le pKa de l’OH est autour de 10 !) ;
donc charge -1,5.
c) Non, les deux sont hydrophobes
QCM Cochez une seule lettre correspondant à la réponse choisie (l’énoncé faux ou l’énoncé juste
selon question) dans la grille jointe (donc 1 réponse/question). Joindre la grille en mettant votre No
d’ANONYMAT à votre copie. (3pts/question)
1. Certains travaux sont liés avec le nom de chercheurs : lequel des énoncés suivants est fausse :
a) Hémoglobine et Max Perutz
b) Cycle d’acide citrique et Krebs
c) Cinétique enzymatique et Marcus Menten
d) Séquençage et Edman
e) Séquençage et Sanger
Je vous ai bien présenté en cours l’histoire de Leonard MICHAELIS et de Maud MENTEN.
Sanger, séquençage ADN ! (donc correcte)

3
2. La liaison peptidique : lequel des énoncés suivants est faux :
a) Les six atomes d’un groupe peptidique (C-CO-NH-C) se
trouvent dans la même plaine
b) La liaison peptidique se trouve entre le groupe carbonyl et le
groupe aminé.
c) La rotation est seulement possible entre C-CO (angle psi)
d) La liaison est mésomerique
e) La liaison est planaire
Deux angles de rotations : psi et phi
3. L’hélice alpha : lequel des énoncés suivants est juste:
a) L’hélice alpha est une structure tertiaire
b) L’hélice contient un dipôle
c) 9,6 résidus ou 5,4 nm font un tour
d) L’hélice est stabilisée par des ponts salins
e) 5,4 résidus ou 9,6 nm font un tour
C’est bien un dipôle. Juste serait : structure secondaire, 3,6 résidus=0.54 nm, stabilisation par liaisons hydrogènes.
Pour 4 et 5, regardez vos polycopiés
4. Lequel des acides aminés suivants peut être impliqués dans une interaction hydrophobe à l’intérieur d’une protéine :
(lequel des énoncés suivants est juste)
a) arginine
b) phénylalanine
c) lysine
d) serine
e) glycine
5. Lequel des acides aminés suivants possède un groupe OH au niveau du résidu (pas COOH !) : (lequel des énoncés
suivants est juste)
a) arginine
b) phénylalanine
c) thréonine
d) tryptophane
e) proline
6 La purification selon la charge (lequel des énoncés suivants est juste)
a) un échangeur d’anion contient des charges négatives sur la
matrice
b) un échangeur d’anion contient des charges négatives dans
le solvant
c) un échangeur de cation contient des charges positives sur
la matrice
7. L’électrophorèse (lequel des énoncés suivants est juste)
a) on ajoute du SDS afin de mieux colorer les protéines
b) on ajoute du SDS afin préserver les complexes de
différentes protéines
c) on ajoute du SDS afin de donner une charge
homogène
d) le SDS est hydrophobe
e) le SDS contient du potassium
le SDS ne colore pas, il est un amphiphile, il dissocie les sous-unités et contient du sodium.
8. Deux protéines sont comparables en terme de taille, de forme et des points isoélectriques. Laquelle des techniques
suivantes est la plus adaptée pour leur séparation ? (Une seule réponse, la juste).
a) Chromatographie native d’exclusion
b) Cristallographie
c) Ultracentrifugation
d) SDS-PAGE
e) Chromatographie d’affinité
Chromatographie native d’exclusion = taille ; La cristallographie n’est pas une méthode de séparation ;
ultracentrifugation trop imprécis ; SDS-PAGE, taille

4
9. La pyruvate dehydrogènase: (lequel des énoncés suivants est faux)
a) Catalyse une réaction qui implique 3 enzymes, 3
cofacteurs et 2 porteurs
b) Contient des ponts disulfures réactifs
c) Est sensible au mercure
d) Est stimulée par le pyruvate
e) Est impliquée dans la décarboxylation oxydative
réversible
réponse e est fausse, car réaction irréversible ; la
solution s’impose aussi car les autres points
(justes) ont été discuté en détail en cours.
10. Quel énoncé concernant le cycle de Krebs est faux :
a) Le cycle de Krebs permet la génération de précurseurs
tels que de neuromédiateurs
b) Le cycle de Krebs génère directement moins d’ATP
que la glycolyse
c) L’aconitase représente un enzyme clé.
d) Le cycle de Krebs nécessite la présence d’oxygène
e) Les carbones du glucose entrent sous la forme de
dicarbones dans le cycle

Licence BCP SCV304 BIOCHIMIE 5
Veuillez répondre à chaque partie (I : Mr J. Lang, II : Mme A. Knoll-Gellida)
séparément sur deux copies distinctes !
Partie II : Structure et métabolisme des lipides
A. Analyse d’un extrait lipidique d’un tissu adipeux
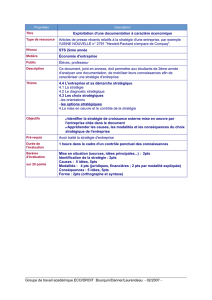
Par traitement d’un tissu adipeux avec un mélange chloroforme-méthanol, on obtient un extrait lipidique
total. Une séparation des constituants de cet extrait par chromatographie sur couche mince de gel de silice
donne le résultat sur la figure ci-dessous.
1) Expliquer le principe d’une CCM. (20pts)
- CCM : phase fixe polaire = plaque silice
phase mobile = solvant (8pts)
- migration du solvant par capillarité (2pts)
- séparation des lipides selon leur polarité/affinité entre les 2 phases ! (10pts)
2) En vue du résultat de la CCM, proposer un changement de polarité du solvant (plus ou moins
polaire que celui utilisé dans la CCM de la figure ci-dessus) qui par sa composition permet
particulièrement une séparation des lipides polaires. (10pts)
Augmenter la polarité du solvant (10pts)
3) Donner un exemple pour chaque type de lipide présent sur la CCM avec son nom, sa formule
développée et préciser son rôle potentiel. (40pts)
- lipide polaire : phosphoglycérolipides ou sphingolipides (2pts)
pour la formule développée regarder dans le polycopié (8pts)
nom précis du lipide choisi (2pts)
rôle structurale dans les membranes (2pts)
- stérol : cholestérol (2pts)
pour la formule développée regarder dans le polycopié (8pts)
rôle structural dans les membranes ; contrôle de la fluidité de la
membrane ; précurseur des hormones stéroïdes et de la vitamine D (4pts)
- lipide neutre : glycéride (Tri-acyl-glycérol, Di-acyl-glycérol…) (2pts)
ligne de dépôt
Sens de
migration
Lipides neutres
Stérol
Solvant
:
éther de pétrole / éther
éthylique / acide éthanoïque
(90/10/1)
Lipides polaires
 6
6
1
/
6
100%