Test formatif – thème 2

SCH3UB – H.Robert Nom:_____________________________
16 septembre 2011
Test formatif – thème 2
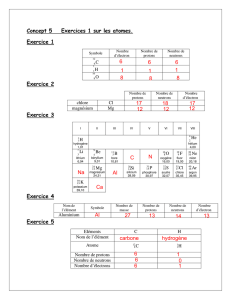
1. Exprime 2 propriétés physiques, autres que le point de fusion et le point d’ébullition, qui serait différente pour
les isotopes du chlore. [2]
___________________________________________________________________________________________
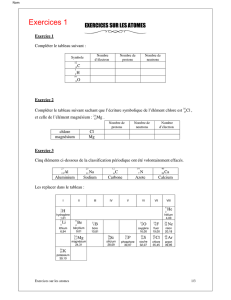
2. Laquelle des espèces chimiques suivantes possède plus d’électrons que de neutrons? [1]
a.
b.
c.
2- d.
-
3. Qu’est-ce qui est pareil dans un atome de phosphore 26 et dans un atome de phosphore 27? [1]
a. Numéro atomique et nombre de masse;
b. Quantité de protons et d’électrons;
c. Quantité de neutrons et d’électrons;
d. Quantité de protons et de neutrons.
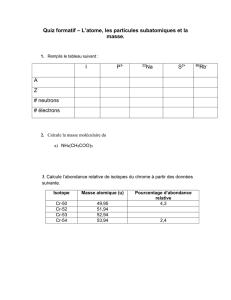
4. Utilise le tableau périodique pour calculer le pourcentage d’abondance du néon 20, en assumant que le seul
autre isotope de cet élément est le néon 22. [4]
5. a) L’abondance relative de 2 isotopes de chlore est montrée dans le tableau ci-dessous. Utilise cette information
pour en déduire le spectre de masse du chlore Cl. [2]
Isotope
Abondance relative
35Cl
75%
37Cl
25%
Commentaire [HR1]:
Densité
Taux de diffusion
Masse
Commentaire [HR2]:
C, il a 8 neutrons et 10 électrons
Commentaire [HR3]:
B
Commentaire [HR4]:
Masse atomique relative =
(20*0.01X) + (22*(1-0.01X)) = 20.18
0.2X + 22 - 0.22X = 20.18
-0.02X + 22 = 20.18
-0.02X = -1.82
X = -1.82/-0.02
X = % d’abondance du néon 20 = 91%
Commentaire [HR5]:
[1] - graphique d’abondance relative en
fonction de m/z
[1] -

b) Utilise le tableau en «a», pour déduire le spectre de masse du Cl2. [5]
6.
Commentaire [HR6]:
35Cl-35Cl : probabilité = ¾ * ¾ = 9/16 en
pourcentage = 56.25%
35Cl-37Cl : probabilité = ¾ * ¼ = 3/16 en
pourcentage = 18.75%
37Cl-35Cl : probabilité = ¾ * ¼ = 3/16 en
pourcentage = 18.75%
37Cl-37Cl = ¼ * ¼ = 1/16 =6.25%
1
/
2
100%