agence beninoise pour l`environnement

MINISTERE DE L’ENVIRONNEMENT DE L’HABITAT ET DE
L’URBANISME (MEHU)
AGENCE BENINOISE POUR L’ENVIRONNEMENT
PROJET DE GESTION COMMUNAUTAIRE DE LA BIODIVERSITE MARINE ET COTIERE
(PGCBMC)
ETUDE D’IDENTIFICATION DES ESPECES INDICATRICES
ADEQUATES ET LEUR INTEGRATION AU SYSTEME DE
SUIVI ECOLOGIQUE
RAPPORT FINAL
Photo IBT, Sept – Oct. 2011 : Visites de terrain auprès des communautés riveraines de la zone côtière

2
Cabinet International Building and Trade (IBT)
10 BP 1021 COTONOU
Tél. (00229) 21 03 16 87 /95 96 49 00 / 97 39 51 10
E-mail : [email protected]; Site Web : www.ibtsarl.com
République du Bénin
Avec
la collaboration technique des cadres du projet
PGCBMC de l’Agence Béninoise pour
l’Environnement
03 BP 4387; Tél. 21 30 45 56, Cotonou
République du Bénin
©Mai2012

3
TABLE DES MATIERES
LISTE DES FIGURES ......................................................................................... 7
LISTE DES TABLEAUX ....................................................................................... 7
CARACTERISATION ................................................................................................ 7
LISTE DES CARTES ........................................................................................... 8
LISTE DES PHOTOS .......................................................................................... 8
1. INTRODUCTION : CONTEXTE, OBJECTIFS ET RESULTATS DE L’ETUDE . 9
1.1- INTRODUCTION ............................................................................................ 9
1.2- CONTEXTE DE L’ETUDE .................................................................................. 10
1.3- OBJECTIFS ET RESULTATS .............................................................................. 11
2. APPROCHE METHODOLOGIQUE DE CONDUITE DE L’ETUDE ................. 13
2.1- REUNION DE CADRAGE AVEC LA COORDINATION DU PROJET A L’ABE ...................... 13
2.2- DOCUMENTATION ........................................................................................ 13
2.3- TRAVAUX PRELIMINAIRES POUR LA COLLECTE DE DONNEES DE TERRAIN ................... 14
2.3.1- Cartographie préliminaire de la zone côtière, objet de l'étude ___________ 14
2.3.2- Identification des Zones Biogéographiques concernées ________________ 14
2.3.3- Elaboration des guides d'entretien ________________________________ 14
2.4- COLLECTE DES DONNEES SUR LE TERRAIN .......................................................... 14
2.4.1- Populations et acteurs rencontrés _________________________________ 15
2.4.2- Types de données collectées _____________________________________ 15
2.4.3- Relevés phytosociologiques et fauniques ____________________________ 15
2.5- TRAITEMENT ET ANALYSE DES DONNEES ........................................................... 16
2.5.1- Traitement général des données __________________________________ 16
2.5.2- Appréciation de l'abondance, de la dominance et de la dynamique des ____ 16
Espèces ___________________________________________________________ 16
2.5.3- Détermination des espèces caractéristiques par la méthode Indval _______ 16
2.5.4- Elaboration d’un guide de suivi écologique __________________________ 17
2.6- ATELIER DE VALIDATION DE LA MISSION .......................................................... 17
3. CADRE BIO-GEOGRAPHIQUE ET BIO-PHYSIQUE DE LA ZONE COTIERE :
ETAT DE REFERENCE DE LA QUALITE DES ZONES HUMIDES ................. 19
3.1- PRESENTATION DU CADRE BIO-PHYSIQUE DE LA ZONE COTIERE .............................. 19
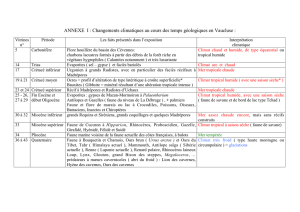
3.1.1- Géologie et pédologie __________________________________________ 19
3.1.2- Climat ______________________________________________________ 21
3.1.2.1- Pluviométrie.........................................................................................................................................21
3.1.2.2- Température........................................................................................................................................23
3.1.2.3- Vents......................................................................................................................................................23
3.1.2.4- Humidité relative...............................................................................................................................24
3.1.3- Hydrographie _________________________________________________ 25
3.1.3.1- Fleuve Mono.........................................................................................................................................25
3.1.3.2- Fleuve Couffo......................................................................................................................................26
3.1.3.3- Lagune côtière....................................................................................................................................26
3.1.3.4- Rivière Sazué......................................................................................................................................26
3.1.3.5- Lac Ahémé............................................................................................................................................26
3.1.3.6- Lacs intérieurs.....................................................................................................................................27
3.1.3.7- Fleuve Ouémé.....................................................................................................................................27
3.1.3.8- Lac Nokoué...........................................................................................................................................28

4
3.1.3.9- Les plans d’eau de Toho et de Todougba.................................................................................28
3.2- PRESENTATION DU CADRE BIO-GEOGRAPHIQUE DE LA ZONE COTIERE ...................... 29
3.2.1- Phytogéographie ______________________________________________ 29
3.2.1.1- Districts phytogéographiques........................................................................................................29
3.2.1.2- Espèces menacées et types de menaces dans la zone côtière.........................................31
3.2.1.3- Mesures de protection.....................................................................................................................33
3.2.2- Zoogéographie ________________________________________________ 34
3.2.2.1- Ichtyofaune..........................................................................................................................................34
3.2.2.2- Amphibiens et Reptiles....................................................................................................................38
3.2.2.3- Faune aviaire.......................................................................................................................................38
3.2.2.4- Mammifères.........................................................................................................................................42
4. DETERMINATION DES ESPECES CARACTERISTIQUES DES ZONES
BIOGEOGRAPHIQUES DE LA ZONE COTIERE : DIAGNOSTIC DES MILIEUX
ECOLOGIQUES ............................................................................................ 44
4.1- DESCRIPTION ET CARACTERISATION DES ZONES BIOGEOGRAPHIQUES CIBLES DE ........ 44
LA REGION COTIERE : IDENTIFICATION DES ESPECES CARACTERISTIQUES ........................ 44
4.2- RICHESSE SPECIFIQUE DES PRINCIPALES UNITES ECOLOGIQUES DE LA ZONE ............. 55
COTIERE : PRESENCE/ABSENCE DES ESPECES ANIMALES ET VEGETALES ........................... 55
4.2.1.- Mangrove de Togbin-Daho ______________________________________ 55
4.2.1.1- Flore........................................................................................................................................................55
4.2.1.2- Faune.....................................................................................................................................................55
4.2.2.- Lagune Gbagan _______________________________________________ 57
4.2.2.1- Flore........................................................................................................................................................57
4.2.2.2- Faune.....................................................................................................................................................58
4.2.3.-Station de Sèmè ______________________________________________ 58
4.2.3.1- Flore........................................................................................................................................................58
4.2.3.2- Faune.....................................................................................................................................................59
4.2.4.-Station de Pahou ______________________________________________ 60
4.2.4.1- Flore........................................................................................................................................................60
4.2.4.2- Faune.....................................................................................................................................................61
4.2.5.- Site de Djègbadji _____________________________________________ 62
4.2.5.1- Flore........................................................................................................................................................62
4.2.5.2- Faune.....................................................................................................................................................62
4.2.6.- Site de Agonèkanmè dans la lagune de Grand-popo __________________ 63
4.2.6.1- Flore........................................................................................................................................................63
4.2.6.2- Faune.....................................................................................................................................................63
4.2.7.- Site de Allongo dans la lagune de Grand-popo _______________________ 65
4.2.7.1- Flore........................................................................................................................................................65
4.2.7.2- Faune.....................................................................................................................................................65
4.2.8.- Site de Athiémé dans la vallée du Mono ____________________________ 66
4.2.8.1- Flore........................................................................................................................................................67
4.2.8.2- Faune.....................................................................................................................................................67
4.2.9.- Site du Lac Toho ______________________________________________ 68
4.2.9.1- Flore........................................................................................................................................................68
4.2.9.2- Faune.....................................................................................................................................................68
4.2.10.- Site de Sèhomi dans la vallée du lac Ahémé _______________________ 69
4.2.10.1- Flore.....................................................................................................................................................69
4.2.10.2- Faune...................................................................................................................................................69
4.2.11.- Région d’Avrankou ___________________________________________ 69
4.2.11.1-Forêt de Latché-Houé Zounmè...................................................................................................69

5
4.2.11.2-Forêt sacrée Oro de Wamon........................................................................................................70
4.2.11.3- Forêt sacrée Oro de Kogbomè....................................................................................................70
4.2.12.- Région d’Adjara _____________________________________________ 71
4.2.12.1- Forêt sacrée de Koun-Koun Tété...............................................................................................71
4.2.12.2- Forêt Oro de Anagodomè.............................................................................................................71
4.2.12.3- Forêt Oro de Lindja-Dangbo........................................................................................................71
4.2.13.- Région d’Ifangni _____________________________________________ 71
4.2.13.1- Forêt Oro de Gblogblo...................................................................................................................71
4.2.13.2- Forêt Oro d’Ifangni.........................................................................................................................72
4.2.13.3- Forêt sacrée de Zian......................................................................................................................72
4.3- IDENTIFICATION DES ZONES BIOGEOGRAPHIQUES .............................................. 72
4.4- APPRECIATION DE L'ABONDANCE ET DE LA DYNAMIQUE DES ESPECES AU SEIN ........... 74
DES ZONES BIOGEOGRAPHIQUES ............................................................................ 74
5. GUIDE DE SUIVI ECOLOGIQUE DES ESPECES CARACTERISTIQUES DES
ZONES BIOGEOGRAPHIQUES DANS LA ZONE COTIERE ............................ 83
5.1- CONTEXTE ET FONDEMENT DU SUIVI ECOLOGIQUE DES ESPECES ............................. 83
CARACTERISTIQUES DES ZONES BIOGEOGRAPHIQUES DANS LA ZONE COTIERE ................... 83
5.2- OBJECTIFS DU SUIVI ECOLOGIQUE AU SEIN DES ZONES BIOGEOGRAPHIQUES ............. 85
5.2.1- Objectif général _______________________________________________ 85
5.2.2- Objectifs spécifiques ___________________________________________ 85
5.3- RESULTATS ATTENDUS DU SUIVI ECOLOGIQUE AU SEIN DES ZONES .......................... 86
BIOGEOGRAPHIQUES ........................................................................................... 86
5.4- ACTIVITES DU SUIVI ECOLOGIQUE AU SEIN DES ZONES BIOGEOGRAPHIQUES ............. 86
5.4.1- Activités du suivi de l’habitat des espèces animales ___________________ 86
5.4-2- Activités du suivi des espèces animales ____________________________ 87
5.5- OUTILS, TECHNIQUES ET METHODES DU SUIVI ECOLOGIQUE .................................. 88
5.5.1- Relevés des données climatiques _________________________________ 89
5.5.2- Relevés de terrain par suivi des parcelles d’observation pour les _________ 89
ressources végétales ________________________________________________ 89
5.5.3- Relevés de terrain à travers les inventaires périodiques de la faune ______ 94
5.5.3.1- Inventaire de la faune mammalienne........................................................................................94
5.5.3.2- Inventaire de la faune aviaire.......................................................................................................96
5.5.4- Suivi par enquête socio-économique _______________________________ 97
5.5.4.1- Enquête socio-économique sur la flore.....................................................................................97
5.5.4.2- Enquête socio-économique sur la faune...................................................................................98
5.5.5- Calcul et traitement des données collectées sur la flore et la faune _______ 99
5.5.5.1- Calcul et traitement des données sur la flore.........................................................................99
5.5.5.2- Calcul et traitement des données sur la faune.....................................................................101
5.5.5.3- Traitement cartographique des données sur la flore et la faune...................................102
5.5.5.4- Calcul de l’Indice d’Intégrité Biotique (IBI) pour le suivi des conditions du milieu103
5.6- ACTEURS DU SUIVI ECOLOGIQUE ................................................................... 114
5.7- GESTION TECHNIQUE ET SCIENTIFIQUE DES DISPOSITIFS/SUIVI- ........................ 114
EVALUATION/CAPACITES LOCALES/GESTION DES BASES DE DONNEES/ ........................ 114
VALORISATION DES RESULTATS ........................................................................... 114
5.8- PERIODICITE DE COLLECTE DES DONNEES DU SUIVI ECOLOGIQUE.......................... 115
5.9- GESTION FINANCIERE DU SUIVI ECOLOGIQUE .................................................. 116
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
1
/
156
100%