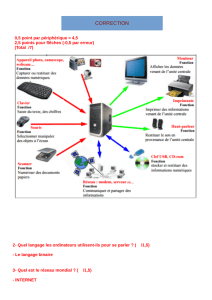
QCM de révision

Terminale S
.QCM de révision.
I. Cinétique chimique et dosage.
1 - La vitesse d'une réaction chimique :
A : Augmente avec la concentration des réactifs
B : Augmente avec la c oncentration des produits
C : Est indépendante de la concentration des réactifs
2 - Quelle(s) affirmation(s) est(sont) correcte(s) ?
A : La vitesse d'une réaction augmente généralement
avec la température
B : La vitesse d'une réaction diminue quand la
température augmente
C : La vitesse d'une réaction est indépendante de la
concentration des réactifs
3 - La trempe
A : Consiste à rajouter de l'eau au milieu réactionnel
B : Consiste à vaporiser le milieu réactionnel
C : Désigne le refroidissement brutal du milieu
réactionnel
4 - Le temps de demi-réaction, noté t ½ est la durée au
bout de laquelle :
A : L'avancement de la réaction est égal à la moitié de
l'avancement maximal
B : L'avancement de la réaction est égal à la moitié de
l'avancement final
C : L'avancement de la réaction est égal à l'avancement
final
5 - Le suivi temporel d'une transformation à partir de
dosages d'oxydoréduction est :
A : Une méthode chimique
B : Une méthode physique
C : Une méthode biologique
6 - Le suivi d'une transformation chimique par titrage
est :
A : Une méthode non destructrice
B : Une méthode destructrice
C : Adapté pour des échantillons de petite taille
7 - Pour réaliser un dosage, on utilise :
A : Une éprouvette graduée
B : Une burette graduée
C : Une fiole jaugée
8 - Un spectrophotomètre mesure :
A : L'absorption d'une solution
B : La longueur d'onde d'une solution
C : L'absorbance d'une solution
9 - Le suivi temporel d'une transformation à l'aide d'un
spectrophotomètre est :
A : Une méthode chimique
B : Une méthode physique
C : Une méthode biologique
10 - L'absorbance A d'une solution colorée de
concentration C :
A : Est proportionnelle à la concentration de la solution si
celle-ci est suffisamment diluée
B : Est donnée par la relation :
C : Dépend uniquement de la couleur de la solution
11 - Avec le spectrophotomètre, on mesure l'absorbance
A d'une solution de permanganate de potassium de
concentration C inconnue : A = 0 ,30.
À l'aide du graphique ci-dessus, on trouve que, la
concentration :
A : C ≈ 1,5 x 104 mol /L
B : C ≈ 1,5 x 10–4 mol /L
C : C ≈ 1,5 x 10–3 mol /L

12 -
Avec un spectrophotomètre, on trace le spectre
d'absorption d'une solution de permanganate de
potassium. On obtient la courbe ci-dessus. La solution
absorbe dans :
A : Le bleu
B : Le vert
C : Le rouge
13 - la solution précédente est :
A : De couleur magenta
B : Incolore
C : De teinte cyan
14 - Le spectre de la lumière blanche après le passage
dans la solution précédente est :
A :
B :
C :
15 - La vitesse volumique de la réaction v (t) à la date t,
A : Est la dérivée par rapport au temps de l'avancement x
de la réaction.
B : Est la dérivée par rapport au temps de du rapport
entre l'avancement x de la réaction et le volume V du
milieu réactionnel
C : Est égale au coefficient directeur de la tangente à la
courbe x = f (t) à l'instant considéré
16 -
On donne ci-dessus la courbe représentant l'évolution
de la concentration C d'un produit de la réaction en
fonction du temps.
La vitesse de la réaction étudiée à la date t peut s'écrire :
.
D'après la courbe, on peut dire que la vitesse initiale de
la réaction :
A : Est inférieure à la vitesse de la réaction à la date t =
2,0 min
B : Est supérieure à la vitesse de la réaction à la date t =
2,0 min
C : Est égale à la vitesse de la réaction à la date t = 2,0
min
17 -
On donne ci-dessus la courbe d'évolution de la
concentration C d'un produit de réaction en fonction du
temps t.
D'après la courbe, on peut dire que le temps de demi
réaction t ½ :
A : Est égal à 1 h 12 min
B : Est égal à 35 min
C : Est égal à 20 min

II. pH, acide et Base, couples Acide / base.
1 - Les propriétés acides et basiques des solutions
aqueuses :
A : Dépendent de la concentration en ions hydroxyde HO–
B : Dépendent de la concentration en ions oxonium H3O+
C : Dépendent de la quantité d'eau
2 - La relation suivante : pH = - log [H3O+] est valable :
A : Quelle que soit la concentration C de la solution
B : Pour les solutions diluées
3 - La relation :pH = - log [H3O+]est équivalente à :
A : [H3O+] = 10–pH mol / L
B : [H3O+] = 10pH mol / L
C : [H3O+] = e–pH mol / L
4 - Pour mesurer le pH d'une solution avec précision, on
utilise :
A : Le papier pH
B : Des indicateurs colorés
C : Le pH-mètre
5 - Pour effectuer une mesure de pH avec un pH-mètre,
il faut avant tout :
A : Plonger la sonde dans la solution, mettre le
commutateur sur la position pH et effectuer la lecture
B : Étalonner le pH-mètre
C : Une solution acide
6 -
On effectue la mesure du pH d'une solution aqueuse.
Après agitation et stabilisation, on obtient la valeur du
pH indiquée sur la photo ci-dessus. La valeur de la
concentration en ions oxonium vaut :
A : [H3O+] ≈ 1,3 x 10–4 mol / L
B : [H3O+] ≈ 1,26 x 10–4 mol / L
C : [H3O+] ≈ 1,0 x 10–3,90 mol / L
7 - Selon Bronsted, un acide est une espèce chimique
capable :
A : De capter au moins un proton H+
B : De céder au moins un proton H+
C : De céder au moins un électron e–
8 - Selon Bronsted, une base est une espèce chimique
capable :
A : De capter au moins un proton H+
B : De céder au moins un proton H+
C : De céder au moins un électron e–
9 - Une base est :
A : Toujours une molécule
B : Toujours un ion
C : Une molécule ou un ion
10 - L'ion hydroxyde HO– est la base conjuguée de :
A : H3O+
B : H2O
C : H2O2
11 - L'eau est une espèce amphotère, on parle
d'ampholyte. Elle peut se comporter :
A : En tant qu'acide seulement
B : En tant que base seulement
C : En tant qu'acide ou en tant que base
12 - Une réaction acido-basique est caractérisée par :
A : Un transfert d'électron de l'acide d'un couple acide /
base vers la base d'un autre couple acide / base
B : Un transfert de proton de la base d'un couple acide /
base vers l'acide d'un autre couple acide / base
C : Un transfert de proton de l'acide d'un couple acide /
base vers la base d'un autre couple acide / base
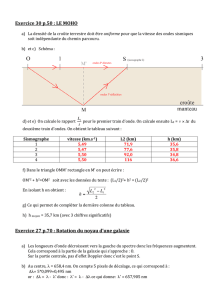
13 - Dans une fiole jaugée de volume V = 500,0 mL,
partiellement remplie d'eau distillée, on verse avec
précaution mapp = 3,00 g d'acide éthanoïque.
On mélange puis on complète avec de l'eau distillée
jusqu'au trait de jauge et on mélange.
(masse molaire de l'acide éthanoïque : 60,05 g.mol-1)
La valeur de l'avancement maximal xmax de la réaction
entre l'acide éthanoïque est l'eau vaut :
A : xmax ≈ 5,00 x 10 –2 mol
B : xmax = 3,00 g
C : xmax ≈ 5,00 x 10 –2 mol / L

14 - Le pH de la solution précédente vaut 2,90.
L'avancement final xf de la réaction entre l'acide
éthanoïque et l'eau vaut :
A : xf ≈ xmax
B : xf ≈ 1,3 x 10–2 mol
C : xf ≈ 6,3 x 10–4 mol
15 - L'avancement final d'une réaction est toujours :
A : 0 ≤ xf < 1
B : 0 ≤ xf ≤ xmax
C : 0 ≤ xf < xmax
16 - Une solution d'acide éthanoïque de concentration
C = 5,0 x 10–4 mol / L a un pH = 4,5. L'avancement final
de la réaction de l'acide éthanoïque sur l'eau :
A : Est égal à l'avancement maximal
B : Est supérieur à l'avancement maximal
C : Est inférieur à l'avancement maximal
17 - Le taux d'avancement d'une réaction est égal :
A : Au quotient de l'avancement final sur l'avancement
maximal
B : Au produit de l'avancement final par l'avancement
maximal
C : Au quotient de l'avancement maximal sur
l'avancement final
III. Réactions acido-basiques en solution
aqueuse.
1 - À 25 ° C, le produit ionique de l'eau :
Ke = [H3O+]eq . [HO– ]eq
Cette constant d'équilibre est associée à la réaction :
A :
B :
C :
2 - L'autoprotolyse de l'eau :
A : Est une réaction très limitée
B : Est une réaction totale
C : Est une réaction acido-basique
3 - On affirme que seulement 2 molécules d'eau sur 556
millions participent à la formation des ions H3O+ et
HO– .
Le taux d'avancement final τ de la réaction
d'autoprotolyse de l'eau vaut :
A : τ ≈ 1
B : τ ≈ 3,6 x 10– 9
C : τ ≈ 3,6 x 10– 7
4 - La constante d'équilibre associée à l'équation
d'autoprotolyse de l'eau, notée Ke est appelé produit
ionique de l'eau.
On donne :
À 25 ° C, pKe = 14
À 60 ° C, pKe = 13
A : La constante Ke est valable pour toutes les solutions
aqueuses
B : La constante Ke augmente avec la température
C : La constante Ke diminue avec la température
5 - Au produit ionique de l'eau, on associe une autre
grandeur nommée pKe. Cette grandeur est définie par la
relation :
A : Ke = – log (pKe)
B : Ke = 10–pKe
C : Ke = – pKe
6 - Une solution neutre :
A : Contient plus d'ions hydroxyde que d'ions oxonium
B : Contient moins d'ions hydroxyde que d'ions oxonium
C : Contient autant d'ions hydroxyde que d'ions oxonium
7 - Une solution basique :
A : Contient plus d'ions hydroxyde que d'ions oxonium
B : Contient moins d'ions hydroxyde que d'ions oxonium
C : Contient autant d'ions hydroxyde que d'ions oxonium
8 - On donne :
À 25 ° C, pKe = 14
À 60 ° C, pKe = 13
À 60 °C, une solution de pH = 7,0 est :
A : Acide
B : Basique
C : Neutre

9 - La constante d'acidité KA associée à la réaction entre
un acide AH (aq) et l'eau a pour expression :
A :
B :
C :
10 - L'expression de la constante d'acidité du couple
NH4+ (aq) / NH3 (aq) est :
A :
B :
C :
11 - Pour tout couple Acide / Base, noté A / B :
A :
B :
C :
12 - Pour les solutions d'acides de mêmes
concentrations C :
A : Le pH est d'autant plus grand que le KA est grand
B : Le pH est d'autant plus faible que le KA est grand
C : Le taux d'avancement final τ est d'autant plus grand
que le KA est grand
13 - Pour les solutions de bases de mêmes
concentrations C :
A : Le pH est d'autant plus élevé que le KA est petit
B : Le taux d'avancement final τ est d'autant plus grand
que le KA est petit
C : La base est d'autant plus dissociée que le KA est grand
14 - On considère la réaction entre l'acide A1H (du
couple A1H / A1–, KA1)
et la base A2– (du couple A2H / A2–, KA2 )
Il se produit la réaction chimique :
À cette réaction est associée une constante d'équilibre
K d'expression :
A :
B :
C :
15 - Une solution de chlorure d'ammonium
a un pH = 11.
Le pKA du couple NH4+ (aq) / NH3 (aq) vaut 9,2.
A : L'espèce prédominante est NH3 (aq)
B : L'espèce prédominante est l'ion ammonium NH4+ (aq)
C : Il n'y a pas d'ions ammonium
16 - Une solution de soude de formulea une
concentration en ions hydroxyde de 1,0 x 10 – 5 mol.L-1.
Son pH, à 25 ° C, vaut :
A : pH ≈ 5,0
B : pH ≈ 9,0
C : pH ≈ 7,0
IV. Titrages acido-basiques.
1 - On réalise le suivi pH-métrique du dosage de l'acide
chlorhydrique par la soude.
À l'équivalence, la courbe représentant l'évolution du
pH en fonction du volume VB de soude versé présente :
A : Un bond de pH
B : Un saut de pH
C : Un pic de pH
2 - La formule de la solution aqueuse de soude est :
A : NaOH (aq)
B : NaOH (s)
C : {Na+ (aq) + HO– (aq)}
3 - L'équation de la réaction de dosage de l'acide
chlorhydrique par la soude est :
A :
B :
C :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%