Premier principe Exercice 1 - Physique

PSI EXERCICES Thermodynamique
Vers la thermodynamique chimique
Premier principe
Exercice 1 : Chauffage par une résistance électrique
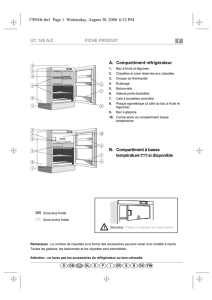
Un cylindre fermé horizontal est divisé en deux compartiments A et B de même volume par un
piston coulissant librement sans frottement. A et B contiennent chacun une mole de gaz parfait à
la pression P0 et à la température T0. On donne pour le gaz parfait
Cpm/Cvm.
Le piston, la surface latérale du cylindre et la surface de base SA du compartiment A sont
athermanes (calorifugés). La surface de base SB du compartiment B est diathermane (autorise les
échanges thermiques).
Le compartiment A est porté très lentement à la température T1 à l’aide d’une résistance
chauffante, le compartiment B reste à T0 par contact thermique avec un thermostat à la
température T0.
1) a) Exprimer les volumes VA, VB et la pression finale P1 en fonction de T1, T0 et V0
correspondant à la position d’équilibre du piston.
b) Quelle est la variation d’énergie interne du gaz à l’intérieur de A et de B ? En déduire la
variation d’énergie interne du système (A B) (notons que la résistance chauffante et le
piston sont exclus du système).
c) Quelle est la nature de la transformation subie par le gaz en B ? Quel est le travail échangé
W par B avec A. En déduire l’énergie thermique Q1 reçue par le thermostat. On exprimera
W et Q1 en fonction de T0, T1 et R la constante des gaz parfaits.
d) En considérant le système A, trouver l’énergie thermique Q2 fournie par la résistance
chauffante en fonction de T0, T1, R et
.
2) Le système étant dans son état final, on suppose
maintenant que la surface de base SB du
compartiment B est également athermane et
qu’une résistance chauffante placée en B apporte
une énergie thermique Q3 de façon à ce que le
piston reprenne très lentement sa position
d’équilibre initial.
a) Quelle est la nature de la transformation subie par le gaz du compartiment A ? Quelle est
la pression finale d’équilibre Pf’, en fonction de T0, T1, V0, R et
?
b) Trouver les températures TA et TB dans chacun des compartiments, en fonction de T0, T1 et
.
c) Quelles sont les variations d’énergie interne dans A, dans B et pour l’ensemble (A B) en
fonction de R,
, TA, T0 et T1 ?
A
B
Thermostat
T0
SB
SA
A
B

PSI EXERCICES Thermodynamique
Vers la thermodynamique chimique
d) Quelle est l’énergie thermique Q3 fournie par la deuxième résistance chauffante ? Exprimer
Q3 en fonction de R,
, T0 et T1.
Exercice 2 Conservation de l’énergie totale d’un système isolé**
Un marteau-pilon P, de masse mp = 1500 kg, tombe d’une hauteur h = 3 m sur un objet en
aluminium à travailler A, de masse ma = 50 kg. La température de P ne varie pratiquement pas
alors que celle de A varie de T.
Calculer T, sachant que la capacité thermique molaire d’un métal est Cvm = 3R et que la masse
molaire de l’aluminium est M = 27 g.mol-1.
Second principe
Exercice 3 Chauffage réversible
Un kilogramme d’eau à t 20°C, est mis en contact avec un thermostat à la température tf 80°C.
On donne ceau 4,18 J.g1.K1.
1) Déterminer la variation d’entropie de l’eau et celle du thermostat. Donner l’entropie
échangée par l’eau et l’entropie créée.
2) On recommence en maintenant d’abord l’eau en contact avec un thermostat à 50°C, puis
avec un thermostat à 80°C. Répondre aux mêmes questions.
3) Comment faudrait-il procéder pour chauffer réversiblement l’eau de 20°C à 80°C ?
Machines thermiques
Exercice 4 Comparaison pompe à chaleur et résistance chauffante***
On considère une pompe à chaleur réversible utilisant un lac à la température TF = 10°C comme
source froide pour élever la température d’une masse M d’eau de 10°C à 40°C. Calculer le travail
W à fournir à la pompe à chaleur pour réchauffer ainsi M = 103 kg d’eau. On donne la capacité
calorifique massique de l’eau : c = 4,18 kJ.kg-1.K-1.
Par comparaison, on apporte la même quantité d’énergie W à une résistance chauffante pour
chauffer la même masse M d’eau. Calculer la nouvelle variation de température T de l’eau.
Conclure.
1
/
2
100%