Partie I : Culture et ensemencement des cellules

INITIATION A LA CULTURE CELLULAIRE ET AUX TECHNIQUES DE LOCALISATION DE
PROTEINES
Partie I : Culture et ensemencement des cellules
Introduction
Le sérum est un liquide imprégnant les cellules et désignant le plasma sanguin lorsque celui-ci est
purifié. Il est composé d’une importante variété de protéines et est souvent utilisé lors de culture cellulaire.
L’objectif de ce TP est de déterminer le rôle du sérum (ici SVF) sur la prolifération cellulaire (Cellules
BHK) ainsi que l’importance de la quantité de cellule ensemencées.
I.Rôle du sérum
Nous avons repiqué les cellules, à partir d’une boite de pétri initiale, afin d’obtenir une même
concentration de cellules, soit 30000 cellules/ml, dans chaque boîte de pétri contenant au préalable un milieu
de culture approprié et des concentrations en SVF différentes (0%,2% ,5%,10% et 15%). Nous procédons à
un comptage cellulaire sur une cellule de Malassez à divers moments (24h, 48h et 72h).
Calcul de la concentration cellulaire dans chaque boîte :
Exemple : Pour 5% de sérum au bout de 72h
On compte 200 cellules pour 100 carreaux.
Volume de la cellule de Malassez : V= 0.2*2.5*2= 1mm3=1μL
Soit concentration=2OO cellules/μL=2.10^5 cellules/mL.
Nous pouvons remarquer quand absence de sérum le nombre de cellules en culture décroît fortement
(de 3.10^5 cellules/mL à 1,47.10^4 cellules/mL en 48h), il y a donc mort cellulaire. Nous supposons que le
sérum joue un rôle dans le maintien et la survie des cellules.
Nous pouvons également observer que pour des concentrations croissantes de sérum, on observe une
prolifération de plus en plus importante (de….. à….). On peut ainsi supposer que le sérum est nécessaire à la
croissance et à la prolifération des cellules et donc à la survie de celles-ci. En effet, le SVF comprenant des
hormones, des facteurs de croissance et de différentiation ainsi que des protéines globulaires (BSA), permet
la prolifération cellulaire.
Toutefois, on observe une saturation pour 15% de sérum. En effet, même avec des taux supérieurs à
10% de SVF dans le milieu, la quantité de cellule ne croît pas davantage. Cette saturation peut être due soit à
une inhibition de la prolifération par contact entre les cellules soit parce que 10% de SVF est la
concentration optimale pour la prolifération cellulaire. Ces 10% de SVF apporterait la quantité de protéines

nécessaire afin d’obtenir une prolifération optimale pour cette concentration cellulaire. Afin de démontrer ou
réfuter ces hypothèses, on peut effectuer la même expérience, avec la même concentration de cellules mais
dans des boîtes de pétri plus grandes. Ainsi si le concentration mesurée est supérieure à celle observée ici
alors la saturation était due à une inhibition de contact et inversement.
Suite à l’observation au microscope optique, de deux cultures cellulaires (8j après ensemencement)
avec ou sans SVF, on remarque que dans la boîte sans SVF, il n’y a plus de cellules. Cependant, dans la
boîte contenant 10% de SVF on observe un tapis de cellules fusiformes (BHK), très dense, tapissant
l’ensemble de la boîte. Ces observations confirment l’expérience précédente ainsi que l’hypothèse de
l’inhibition par contact entre cellules.
II.Rôle de la quantité de cellules ensemencées
Nous effectuons une expérience similaire à la précédente mais cette fois-ci nous ensemençons
différentes concentrations de cellules dans des boîtes contenant un milieu approprié et 10% de SVF.
Nous observons ainsi que lorsqu’on augmente le nombre de cellules de 1000 cellules/mL à 30000
cellules/mL, la prolifération est plus importante (…..). Cependant, lorsqu’on augmente encore la
concentration cellulaire initiale, la prolifération n’augmente plus. En effet, la concentration au bout de 72h
est similaire malgré un nombre initial de cellules différents. Ainsi lorsque la concentration atteint environ
……..cellules/mL, les cellules occupent l’ensemble de la boîte de pétri et la prolifération est stoppée par
inhibition de contact. Cette expérience vient ainsi confirmer la première hypothèse de l’inhibition par
contact.
Partie II : localisation des protéines A et B
Introduction
Dans cette seconde partie, nous allons chercher de déterminer la nature et la localisation cellulaire de
deux protéines à travers plusieurs techniques de colorations (telles que des colorations au MGG et
immunofluorescence) mais aussi via une analyse de fractionnement cellulaire par SDS PAGE et Western
Blot. Des cellules BHK (fibroblastes de hamsters) sont mises en cultures. La première étape consiste à
colorer ces cellules par différentes méthodes, puis les observer au microscope optique inverse (pour la
coloration au MGG) ou microscope optique à fluorescence (pour la coloration avec des anticorps couplés à
des fluorochromes). Nous utiliseront deux sortes d’anticorps, l’un dirigé contre la protéine A, l’autre contre
la protéine B. De cette manière, nous seront en mesure d’émettre des hypothèses quant à leur localisation
dans une cellule BHK.
Ensuite, nous effectuerons un fractionnement cellulaire. Les différentes composantes de la cellule
seront séparées par des méthodes physiques telles que la centrifugation. Nous marquerons de nouveau les
deux protéines et effectuerons des migrations sur gel (SDS-PAGE) et sur membranes de nitrocellulose
(Western Blot). Nous pourrons ainsi confirmer ou réfuter nos hypothèses émises dans la partie précédente
suite aux colorations cellulaires.
Nous proposerons finalement une expérience que l’on pourrait réaliser afin de se rendre compte
définitivement si nos hypothèses s’avèrent exactes ou fausses.
I – Marquage des cellules BHK.
A – Coloration au MGG (May Gumwald Giemsa)
La coloration de May-Grünwald Giemsa est une méthode de coloration qui repose sur l'action
complémentaire de deux colorants neutres et sur l'affinité des éléments cellulaires pour les colorants acides
ou basiques.
Les éléments cellulaires acides, sont colorés sélectivement par des colorants basiques. Ces éléments sont
qualifiés de basophiles (ADN...)
Les éléments cellulaires basiques sont colorés sélectivement par des colorants acides. Ils sont qualifiés
d’acidophiles ou éosinophiles.

Après préparation des nos plaques contenant des lignées cellulaires de BHK, et après les avoir colorés au
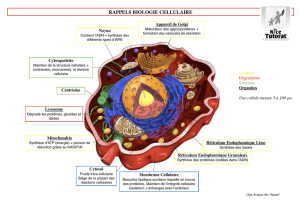
MGG, nous les observons au microscope inversé. On remarque que le noyau apparaît en violet clair alors
qu’en son centre, le nucléole apparaît en violet foncé. Le cytoplasme est également coloré de manière plus
claire, mais contient une multitude de structures arrondies colorées en bleues (on peut penser qu’il s’agit de
vésicules ou encore de ribosomes). (cf. photo 1)
Cette expérience nous permet de localiser avec plus ou moins de précision les constituants subcellulaires des
cellules de BHK.
B – Immunofluorescence
Dans cette partie, nous allons nous intéresser à 2 protéines A et B que nous allons chercher à identifier. Pour
repérer ces protéines, nous allons les marquer via des anticorps dirigés contre elles, couplés soit directement
à un fluorochrome, soit couplé à un anticorps secondaire qui lui sera couplé à un fluorochrome.
Résultats de l’immunofluorescence directe (photo 2) :
Nous constatons un marquage orangé. Les éléments marqués par l’anticorps sont disposés de façon parallèle
dans le cytoplasme de la cellule mais il semblerait que ce soit aussi le cas dans le noyau. Il s’agit donc d’une
protéine qui se répartie uniformément dans la cellule sous forme de réseau. Cependant, il y a un marquage
plus intense au niveau périphérique de la cellule, ou les protéines suivent de manière parallèle le cytoplasme.
Hypothèse 1 : Il s’agirait d’éléments du cytosquelette, peut être des microtubules. Mais dans ce cas, les
protéines de tubulines ne seraient pas organisées de façon parallèle, mais partiraient du centre organisateur
des microtubules (MTOC). Cette hypothèse ne sera donc pas retenue.
Hypothèse 2 : Il s’agirait d’éléments du cytosquelette, appartenant à la famille des protéines d’actine. Les
polymères d’actines arrangées de manière parallèle les unes par rapport aux autre, leur présence au niveau
inférieur de la membrane plasmique, mais également leur présence dans les expansions cytoplasmique
(permettant l’allongement et le dynamisme de ces expansions) sont autant d’arguments en faveur de la
nature actine de ces protéines.
Résultats de l’immunofluorescence indirecte (photo 3) :
Le marquage apparaît de couleur verte. Les protéines marquées sont de forme circulaire (due à la faible
résolution de la microscopie optique ?), réparties de manière assez régulière dans le cytoplasme, mais
totalement absente du noyau. Cette protéine semble très abondante dans la cellule.
Nous pouvons émettre deux hypothèses, qui seront ensuite confirmées ou non dans les expériences de
fractionnement cellulaires avec SDS-PAGE et Western Blot :
-Hypothèse 1 : il s’agirait de protéines présentes dans des vésicules (de sécrétion, lysosomes...)
-Hypothèse 2 : il s’agirait de protéines ribosomales.
II – Fractionnement, Western-Blot et SDS-PAGE.
A – Fractionnement cellulaire et analyse par SDS-PAGE
Après une succession de centrifugation, on fait migrer les différentes protéines présentes dans les
compartiments cellulaires dans un gel de polyaccrylamide.
Les résultats après migration des protéines sont présentés sur la photo 4.
FT : fraction totale
C1 : culot 1 : contenant les noyaux, cellules non cassées et gros débris.
C2: culot 2: mitochondries, RE, ADG, membranes.
S2 : surnageant 2 : cytosol.
1
/
3
100%