TD n°10 - Equilibres d`oxydo

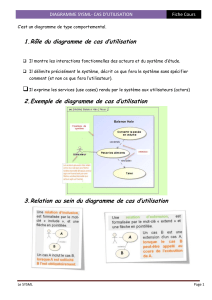
1/5
TD Chimie n°10 : Equilibres d’oxydo-réduction en solution aqueuse
* Exercice 1 : Réactions d’oxydo-réduction en chimie organique
1. Le nitrobenzène peut être réduit en milieu acide et en présence de zinc en aniline. Donner l’équation d’oxydo-réduction
correspondante.
2. On peut obtenir l’éthanal à partir d’éthanol avec le réactif de Sarett (CrO3 dans la pyridine). Donner l’équation d’oxydo-
réduction correspondante.
3. On peut obtenir l’acide éthanoïque à partir d’éthanol avec le réactif de Jones (CrO3 dans l’acide sulfurique concentré). Donner
l’équation d’oxydo-réduction correspondante.
** Exercice 2 : Calcul d’un potentiel standard
1. Données : E° (Cu2+(aq) / Cu (s)) = 0,34 V; E° (Cu2+(aq) / Cu+(aq) ) = 0,17 V.
a. Calculer le potentiel standard du couple Cu+(aq) / Cu (s).
b. Le cuivre au degré d’oxydation +I peut-il exister dans l’eau pure ? Donner l’équation de dismutation correspondante ainsi
que sa constante.
2. L’ion cuivre (I) en présence d’ions iodure peut donner un précipité CuI (s) (pKS = 12).
a. Calculer le potentiel standard du couple CuI(s) / Cu (s).
b. Le cuivre au degré d’oxydation +I peut-il exister en milieu iodure concentré ? Justifier.
3. Données : E0 (Fe3+/Fe2+) =E0 = 0,77 V
(Fe(CN)63-) =
= 1,0.1031
(Fe(CN)64-) =
= 1,0.1024
a. Calculer le potentiel standard E0cx du couple Fe(CN)63- / Fe(CN)64- en fonction de E0, et .
b. Le potentiel standard du couple I2/I- est E’0=0,62 V. Déterminer si les ions iodure peuvent être oxydés par le fer (III), en
l’absence ou en présence d’ions cyanure.
* Exercice 3 : Influence du pH sur des couples biochimiques
Les principaux couples rédox intervenant en biochimie sont : (1) NAD+ / NADH et (2) FAD / FADH2.
On donne leurs potentiels standard biologiques, c’est-à-dire le potentiel standard apparent à pH 7,0 et à 37°C, E1’° = -
0,32V et E2’°= -0,22V.
1. En déduire E1° et E2° puis tracer sur un même diagramme la variation E’° = f(pH). Quel est le meilleur réducteur selon le pH?
2. Dans la cellule, une molécule de fumarate -OOC-CH=CH-COO- est réduite par NADH en succinate -OOC-CH2-CH2-COO-,
de E3’°= 0,34V à pH=7. Calculer la constante thermodynamique K°(T) de la réaction qui se produit.
* Exercice 4 : Etude d’une pile (1)
Données : E0 (Ag+/Ag) = 0,80 V ; E0 (Zn2+/Zn) = - 0,76 V ; F = 96485 C.mol-1
Soit la pile suivante constituée des demi-piles suivantes : 1) une électrode d’argent plongeant dans une solution de nitrate d’argent à
C1 = 10mmol/L et 2) 1) une électrode de zinc plongeant dans une solution de sulfate de zinc à C2 = 15mmol/L. Les béchers constituant
chacune des demi-piles ont un volume identique : V = 50 mL.
1. Calculer les potentiels d’électrode associés à chaque demi-pile ; en déduire la fém de la pile.
2. Préciser les réactions aux électrodes ainsi que le nom et la polarité de ces électrodes.
3. Donner l’équation globale symbolisant le fonctionnement de la pile. Exprimer puis calculer la constante d’équilibre associée.
4. Quelle quantité d’électricité maximale la pile peut-elle débiter ?

2/5
** Exercice 5 : Etude d’une pile (2)
Donnée : E0 (Fe3+/Fe2+) = 0,77 V.
On considère la pile décrite ci-dessous :
Pt / Fe3+ (concentration C), Fe2+ (concentration C), volume V1 // Fe3+ (concentration C), Fe2+ (concentration C), volume V2 // Pt
où C = 0,010 mol/L et V1 = V2 = 50,0 mL
On ajoute une quantité n = 5,00 mmol de fluorure de sodium dans le compartiment (1) de cette pile et on mesure (à 25°C) une fèm E =
0,66V. On indique que l’ion complexe tétrafluoroferrate (III)
FeF4-
se forme alors dans ce compartiment.
1. Donner la polarité de la pile ainsi réalisée.
2. Déterminer la constante de formation globale de l’ion complexe tétrafluoroferrate (III) FeF4-.
3. Exprimer puis calculer E0 (FeF4-/Fe2+).
** Exercice 6 : Etude d’une pile (3)
Données : E0(Ag+/Ag) = 0,80 V.
Dans un bécher (noté 1), on verse 100 cm3 d’une solution de nitrate d’argent (Ag++NO3-) de concentration molaire C1 = 0,1 mol.L-1,
puis on y plonge une électrode d’argent. Cette électrode constitue le pôle positif de la pile.
Dans un second bécher (noté 2), on verse 100 cm3 d’une solution de chlorure de cobalt (Co2++ 2Cl-) de concentration molaire C2 =
0,1 mol.L-1, puis on y plonge une électrode de cobalt.
On relie les deux béchers par un pont salin contenant du nitrate d’ammonium (NH4+ + NO3-). On mesure alors une force électromotrice,
notée
E, aux bornes de la pile ainsi constituée. L’expérience donne :
E = 1,05 V à une température de 25 °C.
1. Ecrire l’équation de la réaction ayant lieu dans la pile quand celle-ci débite.
2. A partir de la donnée sur la force électromotrice de la pile, déterminer, dans les conditions de l’expérience, la valeur du potentiel
standard du couple Co2+/Co(s).
On ajoute dans le bécher 2, contenant des ions Co2+ en solution aqueuse, une pastille d’hydroxyde de sodium NaOH(s). L’hydroxyde de
cobalt Co(OH)2(s) précipite. On mesure alors la force électromotrice de la pile ainsi constituée et on obtient une valeur
E’ = 1,18 V.
Par ailleurs, le pH mesuré vaut 8,9.
3. Déterminer la valeur du produit de solubilité de l’hydroxyde de cobalt (II).
** Exercice 7 : Teneur en chlore d’une eau de Dakin
L’eau de Dakin est un antiseptique vendu en pharmacie dont le nom provient du chimiste britannique Dakin. L’eau de Dakin est
composée d’eau de javel à 1,5 degré chlorométrique et d’une petite quantité de permanganate de potassium ; cette dernière donne la
couleur rosée à la solution et la stabilise car elle peut vieillir et perdre ses principes actifs sous l’effet de la lumière. Cette eau de
Dakin, qui n’est autre qu’une eau de javel très diluée, sert pour le lavage des plaies mais aussi des instruments médicaux. On
souhaite vérifier la teneur en chlore actif d’une eau de Dakin, condition nécessaire à son efficacité.
Protocole expérimental :
- la solution commerciale Scom d’eau de Dakin pharmaceutique, indiquant 0,5 g de chlore actif est diluée 5 fois. On obtient la
solution S1.
- dans un erlenmeyer, on introduit dans cet ordre, V1 = 20,0 mL de solution S1, V2 = 10 mL d’une solution d’iodure de potassium
(K+ + I–) de concentration molaire 0,10 mol.L–1 et 2 à 3 mL de solution d’acide chlorhydrique concentrée à 0,5 mol.L-1. Les
ions iodure sont introduits en excès. Une couleur brune caractéristique du diiode I2 est observée.
- le diiode I2 formé est dosé ensuite par une solution de thiosulfate de sodium (2Na+ + S2O32–) de concentration molaire C3 =
1,00.10–1 mol.L–1. Lorsque la solution devient jaune pâle, on ajoute quelques gouttes d’empois d’amidon. L’équivalence est
détectée pour un volume versé V3 = 5,50 mL.
1. Quelles sont les réactions se produisant au cours des étapes 2 et 3 ? Ces réactions sont-elles totales ? Comment qualifier ce

3/5
titrage ?
2. Déterminer la quantité de matière de diiode I2 formé à la fin de la 2ème étape.
3. En déduire la quantité de matière d’ions ClO– présents dans la solution S1, puis la concentration Ccom de la solution
commerciale en ions ClO–.
4. La teneur en chlore actif de l’eau de Dakin s’obtient en déterminant la masse de dichlore obtenue par la réaction suivante
considérée comme totale : ClO– + 2H+ + Cl– = Cl2 + H2O. En déduire la teneur en chlore actif de la solution commerciale
d’eau de Dakin. Conclure quant à la composition de l’eau de Dakin fournie par le fabriquant.
Données :
Eau de Javel : solution aqueuse comportant du chlorure de sodium (Na+ + Cl–) et de l’hypochlorite de sodium (Na+ + ClO–)
en quantité équimolaire.
Teneur en chlore actif: masse en gramme de dichlore Cl2 formé lorsqu’on verse un excès d’acide chlorhydrique dans V =
100 mL de la solution.
Potentiels standards (à 25°C) :
2
00
1
()/0,62
II
E E V
;
00
2
/0,89
C O Cll
E E V
;
22
4 6 2 3
00
3
/0,09
S O S O
E E V
Masse molaire du chlore : M=35,5 g.mol–1.
I2 est coloré en solution aqueuse (jaune-orangé) ; en présence d’empois d’amidon (thiodène) il prend une teinte bleue-noire
** Exercice 8 : Titre massique en fer d’un anti-mousse
Le sulfate de fer (II) est couramment utilisé comme produit
phytosanitaire permettant de lutter contre la prolifération de
mousse. On trouve par exemple dans le commerce des solutions
prêtes à l’emploi. L’étiquette d’un produit de ce type précise que
le pourcentage massique en ions fer (II) vaut 6%, la solution
ayant pour densité 1,05. On se propose de vérifier le pourcentage
annoncé par le fabriquant en titrant les ions fer (II), contenue
dans une solution préparée à partir du produit phytosanitaire par
une solution de dichromate de potassium
2
27
(2 )K Cr O
.
Pour cela, on prélève 10,0 mL de la solution commerciale d’anti-
mousse (solution S) que l’on introduit dans une fiole jaugée de
100 mL. On complète jusqu’au trait de jauge avec de l’eau
distillée. Après homogénéisation, on obtient la solution S’. On
prélève alors V0 = 20,0 mL de la solution S’ que l’on introduit
dans un bécher. On ajoute 5 mL d’acide sulfurique concentré. On
titre alors le contenu du bécher par une solution de dichromate
de potassium de concentration C1 = 2,00.10–2 mol.L–1. Ce titrage est suivi par potentiométrie, ce qui permet de tracer l’évolution du
potentiel de la solution en fonction du volume de réactif titrant ci-dessus.
Données :
•
3 2
0/Fe 0
1
Fe 0,77 E E V
;
2
27 3
00
2
/1,33
C CrrO
E E V
.
• Masse molaire du fer : M = 55,9 g.mol–1
1. Ecrire le bilan de la réaction support du titrage. Calculer sa constante d’équilibre et conclure.
2. Justifier l’allure de la courbe E = f(V). Peut-on remonter graphiquement à la valeur du potentiel standard du couple Fe3+/Fe2+ ?
Si oui, indiquer en quel point du graphe et justifier.
3. Déterminer la concentration C en ions fer (II) dans la solution commerciale d’anti-mousse.
4. Déterminer alors la valeur expérimentale du pourcentage massique,
100
fer
solution
m
Pm
, en ions fer (II) de la solution
commerciale d’anti-mousse. Comparer cette valeur à celle donnée par le fabricant.

4/5
** Exercice 9 : Diagramme E-pH de l’iode et du soufre
Le diagramme ci-dessous représente les diagrammes E − pH simplifiés de l’iode (en traits pleins) et du soufre (en pointillés). Ces
diagrammes correspondent à une concentration molaire de tracé c = 10−2 mol·L−1 ; on supposera qu’à la frontière entre deux espèces
dissoutes, chaque espèce a une concentration molaire égale à c. Les espèces iodées prises en compte sont les ions I−(aq), IO3−(aq) et
I3−(aq). Les espèces soufrées sont : SO2, SO42-, HSO3- et SO32-.
1. Etude du diagramme E-pH de l’iode
a) Attribuer, en justifiant, chacun des domaines (A, B et C) du diagramme à l’une des espèces iodées (I-, I3- et IO3-). On
admettra qu’un nombre d’oxydation peut ne pas être entier.
b) Quelle espèce subit une réaction de dismutation ? Au-delà de quel pH ? Donner l’équation-bilan de cette réaction de
dismutation.
c) A partir du diagramme, déterminer le potentiel standard du couple I3- / I-.
d) Déterminer la pente des 3 droites constituant ce diagramme.
2. Etude du diagramme E-pH du soufre
a) Attribuer chacun des domaines (D, E, F et G) du diagramme à l’une des espèces soufrées (SO2, SO42-, HSO3- et SO32-).
Justifier.
b) Donner les valeurs, en justifiant, des pKa des couples SO2(aq)/HSO3−(aq) et HSO3−(aq)/SO32–(aq).
3. Application
Dans quel domaine de pH l’oxydation du soufre (+IV) par les ions triiodure I3−(aq) est-elle possible ? Écrire l’équation de cette
réaction, selon le pH de travail.
A
B
C
D
E
F
G
C
1,0
0,5
0
- 0,5
- 1,0
1,5
E (V)
pH
0
2,0
4,0
6,0
8,0
10,0
12,0

5/5
*** Exercice 10 : Diagramme E-pH du Chrome
Données à 25°C et pH = 0 : E°( O2(g) / H2O)= 1,23V et E°( H2O / H2(g))= 0,00 V
On donne le diagramme potentiel-pH de l’élément chrome ci-contre. On
indique que La concentration de travail est égale à 0,1 mol.L-1.
1. Le diagramme ci-dessus fait intervenir les espèces suivantes : Cr(s), Cr(OH)3 (s),
Cr2+(aq), Cr3+(aq), Cr(OH)4-(aq), Cr2O72-(aq) et CrO42-(aq). Placer ces espèces dans le
diagramme ci-dessus en justifiant. On écriera notamment l’équation-bilan liant les
espèces Cr2O72-(aq) et CrO42-(aq) pour les placer correctement sur le diagramme.
2. Déterminer à partir du diagramme :
a. Les potentiels standards E° (Cr2+/Cr) et E° (Cr3+/Cr2+)
b. Le produit de solubilité KS de Cr(OH)3(s)
c. La constante globale de formation du complexe Cr(OH)4
3. a. Quelles sont les espèces, contenant l’élément chrome, thermodynamiquement stables dans l’eau ?
b. Ecrire l’équation-bilan de la réaction traduisant l’action du chrome métallique sur de l’eau pure.
c. Que se passe-t-il pour le Cr(II) au-delà de pH = 7,0 ? Ecrire l’équation-bilan correspondante.
1
/
5
100%