ds3_enonce - PCSI Chimie

!
"!
!
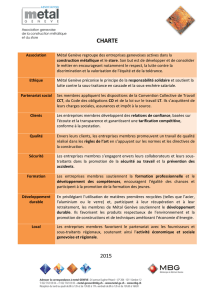
!"#$%&'%()&*(+,%,&-&!(&./#0%11%&2&&&&&&&&&&&&&&&&&&&&&&&&&&&&3%+45&67&4$#%89:%&;<6=&
!
>?@A@B&&C>D@&
&
!E(8/+:&
!(&F+%::%!
&
G&%,&H%:I$15+J&K677L&-&6MNMO&
&
&
*%P/5:&D+:P%511$&)QR&
!

!
#!
!
!
$%&'(!)%!)(*+,&!-!;&0%+:%J!
!
./%0,1,230,+4!)(!13!5315%130&,5(!4/(20!632!3%0+&,2'(!
!
!.(2!(7(&5,5(2!2+40!,4)'6(4)3402!8!,12!6(%*(40!90&(!0&3,0'2!)342!%4!+&)&(!:%(15+4:%(;!!
!<(4)(=!)(2!5+6,(2!6&+6&(2>!1,2,?1(2>!(0!)342!1(2:%(11(2!1(2!4%@'&+2!)(2!:%(20,+42!2(&+40!
?,(4!&(6+&0'2;!
!A4!&'2%1030!:%,!4(!2(&3!632!(40+%&'!+%!2+%1,B4'!2(&3!,B4+&'!63&!1(!5+&&(50(%&C!
!D1!4/(20!632!4'5(223,&(!)(!0+%0!0&3,0(&!6+%&!&(4)&(!%4(!?+44(!5+6,(!!
!
E00(40,+4>!*+%2!)(*(=!0&3,0(&!%4!2(%1!)(2!)(%7!(7(&5,5(2!)(!5,4'0,:%(!
!
!!!
!
EXERCICE 1 :&DANS%LA%CLASSIFICATION%CHINOISE!
!
F0%),+42! 13! 51322,G,530,+4! 6'&,+),:%(! 5H,4+,2(>! +4! I! &(0&+%*(! '*,)(@@(40! 1(2! @9@(2!
'1'@(402! 3%7! 6135(2! ,)(40,:%(2! J! 5(11(! :%/,12! +55%6(40! )342! 13! 51322,G,530,+4!:%,! 4+%2! (20!
G3@,1,K&(;!!
!
!
!
"L M%(1! (20! 1(! 5&,0K&(! )(! 51322(@(40! )(2! '1'@(402! 5H,@,:%(2! )342! 13! 51322,G,530,+4!
350%(11(!N!
!
!
!
!
!

!
O!
D40'&(22+42P4+%2!J!1/'1'@(40!!5H,@,:%(!(40+%&';!
Q(0!'1'@(40!(20!1(!2%,*340!-!
!
!
#L M%(1!(20!1(!4%@'&+!30+@,:%(!)(!5(0!'1'@(40!N!!
!
OL F5&,&(!23!5+4G,B%&30,+4!'1(50&+4,:%(!G+4)3@(4031(;!
!
RL $'0(&@,4(&! 5+@?,(4! %4! 30+@(! )(! 5(0! '1'@(40! 6+22K)(! )/'1(50&+42! )(! 5S%&>!
)/'1(50&+42!)(!*31(45(!(0!)/'1(50&+42!5'1,?303,&(2;!!
!
TL Q(0!'1'@(40!(20P,1!%4!@'031!N!<(6&'2(40(&!366&+7,@30,*(@(40!13!G&+40,K&(!(40&(!1(2!
@'03%7!(0!1(2!4+4P@'03%7!2%&!13!51322,G,530,+4!5H,4+,2(!U+,40(!(4!344(7(;!
!
VL F40+%&(&! )342! *+0&(! 5+6,(! 1(! 2I@?+1(! 5H,4+,2! )(! 1/H'1,%@! W(>! )%! 1,0H,%@! .,>! )(!
1/+7IBK4(!X!(0!)%!5H1+&(!Q1;!
!
YL Q+1+&'!13!5+1+44(!)(2!H31+BK4(2;!
!
!
EXERCICE 2 :%VANADIUM%ET%THORIUM%
Z1,?&(@(40! ,426,&'! )(! 1/3&0,51(! [!!"#$% &'(#"%
)*+,-."./#012!\! 63&%! )342!1/E50%31,0'! 5H,@,:%(!
]!@3,!#^"T!P!!4_!O`VL!
!
!
!
a&b5(!3%!B&34)!5H,@,20(!2%')+,2!c(&=(1,%2>!13!@I0H+1+B,(!2534),43*(!(20!&(6&'2(40'(!)342!
13!51322,G,530,+4!)(2!'1'@(402!63&!1(!34$4-%(0!1(!*+.5#1-;!
.(!*343),%@!3!6+%&!2I@?+1(!S!(0!6+%&!4%@'&+!30+@,:%(!T&U&;R;!!
.(!0H+&,%@!3!6+%&!2I@?+1(!V0!(0!6+%&!4%@'&+!30+@,:%(!T&U&L<;!
!
D1!(7,20(!)(%7!,2+0+6(2!)%!*343),%@!-!
``>YT!d!)(!1/,2+0+6(!)(!@322(!@+13,&(!R`>`T!B;@+1P"!(0!^>#T!d!)(!1/,2+0+6(!)(!@322(!@+13,&(!
T^>`R!B;@+1P";!
"L $+44(&!13!5+@6+2,0,+4!)(2!4+I3%7!)(!5(2!)(%7!,2+0+6(2!)%!&%0H'4,%@;!!
!
#L F5&,&(!13!5+4G,B%&30,+4!'1(50&+4,:%(!G+4)3@(4031(!)(!1/30+@(!)(!*343),%@;!F4+45(&!
13!&KB1(!)(!e1(5Hf+g2f,!%0,1,2'(!6+%&!6&+6+2(&!5(00(!5+4G,B%&30,+4;!
!
OL $'03,11(&! 1(! &(@61,223B(! )(! 13! )(&4,K&(! 2+%2P5+%5H(;! F4+45(&! 13! &KB1(! :%(! *+%2!
%0,1,2(=;!
Clin d’œil étymologique
3
l’actualité chimique - mai 2015 - n° 396
C’est une histoire pleine de rebondissements que celle de la
découverte du vanadium, dont le nom nous entraîne dans la
mythologie scandinave, certainement moins présente que les
références gréco-latines dans les appellations de la chimie.
Une découverte incomprise, au Mexique
En 1801, l’histoire commence pourtant à Mexico, où le minéra-
logiste del Rio annonçait la découverte d’un nouveau métal
dans un minerai du Mexique. Cependant, la communauté scien-
tifique a considéré que le métal en question n’était que du chro-
me impur. En fait, c’est del Rio qui avait raison. On a compris
plus tard qu’il avait bien trouvé le vanadium, situé dans la clas-
sification juste à côté du chrome. Vauquelin venait d’identifier
ce dernier métal, et de le nommer en 1798 à partir du grec
khrôma, « couleur », à cause de ses sels diversement colorés.
Le métal que del Rio pensait avoir trouvé produisait d’ailleurs
des sels de couleur rouge intense, d’où le nom erythronium, du
grec eruthros, « rouge », qu’il avait proposé, en vain.
La redécouverte, en Suède
Près de trente ans plus tard, le chimiste et minéralogiste suédois
Nils Gabriel Sefström, examinant « une espèce de fer remar-
quable par son extrême mollesse », montrait qu’un nouvel élé-
ment était responsable de cette propriété, et redécouvrait ainsi
le vanadium. Sefström travaillait alors chez son ancien profes-
seur, Berzelius, qui écrivait en 1830 : « Nous n’avons pas enco-
re fixé définitivement le nom de cette substance. Nous l’appe-
lons provisoirement vanadium, de Vanadis, nom d’une divinité
scandinave. » Berzelius laissait la primeur de l’annonce à
Sefström, qui confirmait, dès 1831, le nom du nouveau métal :
« Comme le nom est indifférent par lui-même, je l’ai dérivé de
Vanadis, surnom de Freyja, principale déesse de la mythologie
scandinave. » Un nom peut-être pas si indifférent que cela, puis-
qu’il lui permettait de signer cette découverte d’un nom scandi-
nave. Compte tenu de l’originalité des travaux de Sefström, la
communauté scientifique a effectivement retenu vanadium, au
détriment d’erythronium proposé par del Rio.
La déesse Vanadis, une inspiratrice
Dans la mythologie scandinave, les dieux se répartissent entre
les Ases, qui ont des pouvoirs de justice et de guerre, et les
Vanes, tournés vers la fertilité et la prospérité. Freyja fait partie
des Vanes, d’où son surnom de Vanadis. Comme Vénus chez les
Romains, elle est la déesse de la fécondité et de la beauté, des
qualités illustrées par le vanadium, qui est remarquable par la
diversité et les riches couleurs de ses dérivés.
Berzelius était, semble-t-il, inspiré par Vanadis. Dans une lettre
de 1831 à son confrère allemand Wöhler, célèbre pour avoir
réussi la synthèse de l’urée, voici à peu près ce qu’il écrivait :
vous avez frappé une fois à la porte de Vanadis, elle n’a pas
répondu, et vous n’avez pas insisté, mais quelque temps après
Sefström n’a cessé de frapper à sa porte, elle a fini par s’ouvrir,
et « de cette union est né le vanadium ». Une puissante méta-
phore que Wöhler a prise du bon côté puisque la même année,
il écrivait cette fois à Liebig : « je suis un âne » de ne pas avoir
découvert le vanadium dans le minerai mexicain. Pour terminer
sur ces échanges, citons encore Berzelius, consolant Wöhler en
lui disant que la synthèse de l’urée nécessitait plus de génie
« que la découverte de 10 nouveaux éléments. »
Que d’émotion autour du vanadium… et de la belle Vanadis...
qui, plus tard, a aussi inspiré les astronomes, puisqu’un astéroï-
de découvert en 1884 a été baptisé Vanadis : encore une corres-
pondance entre un astre et un métal (cf. À propos de l’uranium,
L’Act. Chim. n° 395), mais a priori fortuite cette fois.
Thor, une autre divinité scandinave
Berzelius avait déjà puisé dans la mythologie scandinave pour
nommer thorium en 1818 un métal qu’il croyait nouveau, à par-
tir du nom de Thor, le dieu du tonnerre et des éclairs. Armé de
son marteau, ce dieu est un avatar de Jupiter, et de Donar dans
la mythologie germanique. Plus tard, lorsque Berzelius
découvre, réellement cette fois, un nouveau métal en 1829,
à peu près en même temps d’ailleurs que la redécouverte du
vanadium, il reprend ce nom thorium.
Dans la classification, le thorium (Th), 90eélément et 2eactini-
de, est fort éloigné du vanadium (V), 23eélément et 3emétal de
transition. Pourtant, dans la symbolique des jours de la semai-
ne, le jeudi/Thursday/Donnerstag, dédié à Jupiter, Thor et
Donar, précède juste le vendredi/Friday/Freitag, dédié à Vénus,
Frigg et Freyja, dite Vanadis, parfois confondue avec Frigg.
Épilogue
Grâce au grand chimiste suédois Berzelius, la mythologie scan-
dinave est représentée dans la classification des éléments par le
vanadium et le thorium.
La déesse Vanadis, parmi les Vanes, en face du dieu Thor, parmi
les Ases, symbolisant le vanadium, un oligoélément, qui rend
l’acier ductile et donne des dérivés de toute beauté, en face du
thorium, deux fois plus lourd, radioactif, et dont l’oxyde résiste
aux très hautes températures… Serait-ce une référence implici-
te à la philosophie du yin (yin est la terre, la souplesse, le
« féminin ») et du yang (yang est le ciel lumineux, la dureté
et le « masculin »), à la base de l’alchimie chinoise ?
À propos du vanadium
Pierre Avenas a été directeur de la R!&!D
dans l’industrie chimique.
Courriel!: [email protected]
Le couple de la mytholo-
gie nordique!Freyja ou
Vanadis, déesse de la
beauté et de la fertilité,
et Thor, dieu du tonner-
re!et de la guerre : une
alchimie des principes
contraires inspiratrice
des noms des éléments
chimiques vanadium (V)
et thorium (Th)!!

!
R!
!
RL <(@61,&!1(!03?1(3%!6&'5,2340!1(2! 4+@?&(2! :%340,:%(2!)(!0+%2!1(2!'1(50&+42!)(!5(00(!
2+%2P5+%5H(;!!.--2%"26%)"27*5.$6%&26%)")-2$*6%&2%"4%7"466#8#74*#.$%92132$*%.771925%&26%
6.16:7.17+26% ;8<% "2% *4="241% >% 52-9"#5% 7.-9.5*2% ?;% "#/$26<% -4#6% 3.16% $'432@% 921*:A*52%
=26.#$%012%&2%012"0126%"#/$26%9.15%&)75#52%"26%)"27*5.$6%&2%"4%&25$#B52%6.16:7.17+2;!
!
TL .+531,2(&!1(!*343),%@!)342!13!51322,G,530,+4!U+,40(!5H,4+,2(!)(!1/(7(&5,5(!"!-!6'&,+)(!(0!
5+1+44(!N!
!
VL E!:%(1!?1+5!3663&0,(40!1(!*343),%@!N!
!
YL .(! *343),%@>! )(! 63&0! 23! 6+2,0,+4! )342! 13! 51322,G,530,+4! (20P,1! (20! %4! @'031!N! Q,0(=! R!
6&+6&,'0'2!5+@@%4(2!J!0+%2!1(2!@'03%7;!
!
hL i&+@(4+42P4+%2!)342!13!6'&,+)(!Zj1,B4(L!)%!*343),%@;!.(!6+0322,%@!W!(20!1/31531,4!
:%,! 3663&0,(40! J! 13! @9@(! 6'&,+)(! :%(! 1(! *343),%@;! k,0%(=P1(! )342! 13! 51322,G,530,+4!
6&'5')(40(;!
!
`L M%(1!(20!1(!4%@'&+!30+@,:%(!)(!1/H31+BK4(!:%,!3663&0,(40!J!13!@9@(!6'&,+)(!:%(!1(!
*343),%@!N!k3!5+4G,B%&30,+4!'1(50&+4,:%(!(70(&4(!N!k+4!2I@?+1(!N!
!
"^L !i&+@(4+42P4+%2! )342! 13! 5+1+44(! )%! *343),%@;! .(! 4,+?,%@! X9! Z)+40! 1(! 4+@!
6&+*,(40!)(!l,+?'(>!G,11(!)(!m34031(>!:%,!3!)+44'!)(!2+4!5n0'!1(!034031(!V(L!!(20!2,0%'!
U%20(!(4!)(22+%2!)342!13!51322,G,530,+4!6'&,+),:%(;!M%(1!(20!2+4!4%@'&+!30+@,:%(!N!
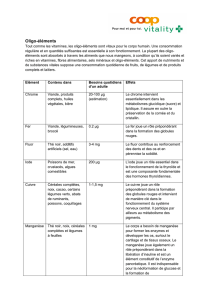
$342!1(!@+4)(>!+4!6&+)%,0!61%2!)/35,)(!2%1G%&,:%(!W#kXR!:%(!0+%0!3%0&(!6&+)%,0!5H,@,:%(;!
`^!d!)(!13!6&+)%50,+4!2(!G3,0!63&!1(!6&+5')'!)(!5+40350>!)+40!1/'036(!51(G!(20!1/+7I)30,+4!)(!
kX#!(4!kXO!2%&!%4!53031I2(%&!J!?32(!)(!*343),%@>!1(!6(403+7I)(!)(!),*343),%@!o#XT;!
""L !M%(12!2+40!1(2!'1(50&+42!)(!*31(45(!)%!*343),%@!N!
!
"#L !<366(1(=!13!)'G,4,0,+4!)(!1/'1(50&+4'B30,*,0'!χ!)/%4!'1'@(40;!E!:%(1!5H,@,20(!)+,0P+4!
1/'5H(11(!)/'1(50&+4'B30,*,0'!13!61%2!%0,1,2'(!(4!5H,@,(!+&B34,:%(!N!M%(1!(20!1/'1'@(40!
1(!61%2!'1(50&+4'B30,G!)(!13!51322,G,530,+4!6'&,+),:%(!N!
!
"OL !p%20,G,(=!13!20+(5H,+@'0&,(!)(!1/+7I)(!-!o;X=;!
./'4(&B,(! 4'5(223,&(! 6our$ arracher$ un$ électron$ à$ un$ atome$ de$ ruthénium$ est$ de$ 650,9!
fpq@+1r">!31+&2!:%/,1!G3%0!"R"R!fpq@+1r"!6+%&!3&&35H(&!1(!)(%7,K@(;!!
"RL !F5&,&(! 13! 5+4G,B%&30,+4! '1(50&+4,:%(! )(2! ,+42! os!(0! o#s! 2%55(22,*(@(40! +?0(4%2;!
D40(&6&'0(&!5(00(!),GG'&(45(!)/'4(&B,(!)/,+4,230,+4;!!
!
.(!0H+&,%@>!)(!2I@?+1(!V0>!)+,0!)+45!'B31(@(40!2+4!4+@!J!mH+&>!$,(%!)(!13!B%(&&(!(0!)%!
0+44(&&(!)342!13!@I0H+1+B,(!2534),43*(;!.(!4%@'&+!30+@,:%(!)%!0H+&,%@!(20!t!j!`^;!!

!
T!
"TL !F5&,&(!13!5+4G,B%&30,+4!'1(50&+4,:%(!G+4)3@(4031(!)%!0H+&,%@!(4!&(26(50340!13!&KB1(!
)(!e1(5Hf+g2f,;!$342!:%(1!?1+5!2(!2,0%(P0P,1!N!
!
EXERCICE 3 :%SYNTHESE%DE%L’ACIDE%ACANTHOÏQUE%
!
./35,)(! 35340H+u:%(! (20! %4! ),0(&6Kne# tricyclique# isolé# de# l’C74$*+.94$4D% E.524$1->! 3&?%20(!
6+%22340!)342!1/v1(!)(!p(U%!(4!Q+&'(>!63&!QWAla!(0!2(2!5+113?+&30(%&2!(4!"`hh;!$(2!'0%)(2!2%&!1(2!
6&+6&,'0'2!?,+1+B,:%(2!)(!5(!6&+)%,0!430%&(1!+40!@,2!(4!'*,)(45(!:%(!1/35,)(!Z]LP35340H+u:%(!(20!%4!
3B(40!340,P,4G13@@30+,&(!6%,22340;!!
!
!
"L M%(1! (20! 1(! 4+@?&(! )/,4230%&30,+4! )(! 5(00(! @+1'5%1(! N! $'0(&@,4(&! 23! G+&@%1(!
@+1'5%13,&(! Z+%! ?&%0(L! (4! 5+@60340! 1(2! 30+@(2! )(! 53&?+4(! (0! +7IBK4(>! (0! (4!
)')%,2340!1(!4+@?&(!)/30+@(!)/HI)&+BK4(!)%!4+@?&(!)/,4230%&30,+4>!(4!(761,:%340;!
.(! K2O!)342! 1(! 4+@! )(! 1/35,)(! ZPLP35340H+u:%(! 2,B4,G,(! :%(! 5(00(! @+1'5%1(! (20! 1'*+BI&(;!
<366(1(&!5(!:%(!5(13!2,B4,G,(;!l+@@(&!1/3663&(,1!6(&@(00340!)(!@(2%&(&!5(00(!6&+6&,'0'!(0!
(4!G3,&(!%4!25H'@3!344+0';!
Les$réponses$aux$questions$2,3!et!5!pourront!être!directement!données#sur#l’annexe#à#:%)4:%&
(P%#&P/,:%&#/Y5%Z!
#L F40+%&(&!(0!4+@@(&!13!G+450,+4!5H,@,:%(!6&'2(40(!)342!1/35,)(!35340H+u:%(;!
!
OL <(6'&(&! 0+%2! 1(2! 5(40&(2! 20'&'+BK4(2! )(! 1/35,)(! 35340H+u:%(! -! *+%2! @3&:%(&(=! 1(2!
'*(40%(12!30+@(2!)(!53&?+4(!32I@'0&,:%(2!63&!%4(!320'&,2:%(!w!(0!(40+%&(&(=!13!+%!
1(2!'*(40%(11(Z2L!)+%?1(Z2L!1,3,2+4Z2L!),22I@'0&,:%(2;!
 6
6
 7
7
 8
8
1
/
8
100%