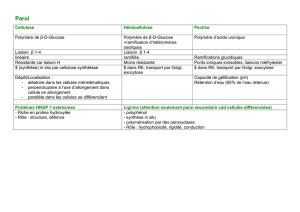
Semaines du 16 au 28 novembre

Semaines du 18 au 29 mars 2013
Programme des colles de chimie 11 - Spé PC
Toute la chimie organique des deux années
est au programme de ces deux dernières
semaines de colle.
Semaine du 18 au 22 mars
Révisions :
- Toute la chimie organique des deux années (dernier chapitre abordé : Chapitre B.7 :
Hydrocarbures aromatiques)
- Chapitre A.5 et A.5 bis : Equilibres de phase dans le cas des mélanges binaires solide-
liquide et liquide-vapeur
Nouveautés : Chapitre C3 : Aspect cinétique de l’hydrométallurgie - Courbes
intensité-potentiel
• Connaître le lien entre vitesse d’une réaction électrochimique et intensité
• Connaître les mécanismes d’une réaction électrochimique (transfert de matière -
transfert de charge)
• Savoir dessiner le montage à 3 électrodes permettant le tracé d’une courbe intensité-
potentiel
• Connaître la différence entre système lent et système rapide (connaître le terme de
surtension) ; savoir que cette notion dépend de la nature de l’électrode
• Savoir que les courbes i-E peuvent présenter des paliers de diffusion
• Savoir expliquer pourquoi certaines réactions thermodynamiquement favorisées ne sont
pas observées de manière quantitative (blocage cinétique - exemple de l’attaque acide de
métaux)
• Savoir ce qu’est une électrolyse et comment on détermine la tension de seuil nécessaire
à sa réalisation à l’aide des courbes i-E
• Connaître les étapes principales de l'hydrométallurgie du zinc (vocabulaire – intérêt) ;
par exemple :
–savoir commenter la vitesse des réactions intervenant lors de la cémentation à
l'aide des courbes i-E
–savoir déduire des courbes i-E les processus observés à l'anode et à la cathode lors
de l'électrolyse finale
1

Semaine du 25 au 29 mars
Même programme que la semaine du 18 au 22 mars
- Toute la chimie organique des deux années
- Chapitre A.5 et A.5 bis : Equilibres de phase dans le cas des mélanges binaires solide-
liquide et liquide-vapeur
- Chapitre C.3 : Aspect cinétique de l’hydrométallurgie - Courbes intensité-potentiel
+
Nouveautés : Chapitre C4 : Aspects thermodynamique et cinétique des
phénomènes de corrosion
• Savoir interpréter (thermodynamiquement et cinétiquement) un résultat expérimental (à
l’aide des diagrammes E-pH et des courbes i-E)
• Connaître la différence entre corrosion uniforme et corrosion différentielle
• Savoir expliquer une expérience de corrosion différentielle par la formation d’une
micropile
Expérience vue en cours : expérience de la goutte d’Evans
• Savoir quels facteurs favorisent la corrosion différentielle
• Savoir citer et expliquer les différentes méthodes de protection contre la corrosion
(passivation - dépôt d’une couche de métal - anode sacrificielle – protection avec emploi
d'un générateur)
Nouveautés : Chapitre C.5 : Généralités sur les polymères
• Savoir définir un polymère (connaître les termes d’unité de répétition, de monomère, de
copolymère) ; savoir citer au moins 2 ou 3 exemples de polymères
• Savoir définir le degré de polymérisation et la masse molaire moyenne (en nombre et
en masse) d’un polymère
• Connaître la différence existant entre un polymère linéaire, un polymère ramifié et un
polymère réticulé
• Savoir expliquer ce qu’il se passe pour un polymère dans le cas où on élève la
température (notion de transition vitreuse) si le polymère est amorphe et non réticulé, si
le polymère est amorphe et réticulé, si le polymère est semi-cristallin
2
1
/
2
100%


![Biocompatibilité des polymères [Mode de compatibilité]](http://s1.studylibfr.com/store/data/004845602_1-0676c2f26aefaaf094e4d02094640c45-300x300.png)