énoncé

Spé ψ 2004-2005 page 1/4 Devoir n°5
Spé ψ 2004-2005 Devoir n°5
ÉLECTROMAGNÉTISME
Partie I
HYDROMETALLURGIE DE L’ETAIN
L’étain nom (symbole Sn, masse molaire M = 117,8 g mol–1) est un métal est utilisé depuis
l'âge du bronze. Son vient du latin stannum (on parle par exemple de chlorure stannique). L'étain
est un métal gris-argenté, mou, malléable et ductile. Sur les surfaces en contact avec l'air il se
forme un film d'oxyde. Il ne réagit ni avec l'oxygène, ni avec l'eau. Il réagit avec les acides et les
bases. Les dérivés organiques de l'étain peuvent être très toxiques.
I-1) On obtient par pyrométallurgie de l’étain impur (principale impureté Ag) que l’on peut
purifier par électrolyse à anode soluble. L’électrolyte est une solution d’eau acidulée (H2SO4,
pH = 3), contenant du sulfate stanneux totalement dissocié (SnSO4 c = 0,01 mol.L–1). En solution
aqueuse, les ions sulfate sont électroinertes. La cathode est une feuille mince d’étain pur.L’anode
est un barreau d’étain brut (impureté Ag) à purifier.
a) Écrire toutes les équations possibles aux électrodes. Placer les courbes intensité-
potentiel en tenant compte du pH, des données redox et des surtensions cinétiques.
b) Conclure sur la réaction d’électrolyse. Justifier alors le nom d’électrolyse à anode
soluble et préciser ce que devient l’impureté Ag contenu dans le barreau brut.
I-2) Une autre technique possible consiste à transformer SnO2 par lixiviation acide (H2SO4)
en Sn4+ c = 0,1 mol.L–1 (impureté Ag+ à 1%) puis à réaliser l’électrolyse de la solution sulfurique
(pH = 3). a) Préciser les nouvelles réactions possibles aux électrodes (anode en aluminium, Al
non électroactif, et cathode en plomb). Donner les courbes intensité potentiel.
b) Justifier ici la nécessité d’une cémentation (la définir) préalable pour éliminer
Ag+.c) Préciser alors la réaction d’électrolyse et estimer la tension nécessaire
d) Calculer la masse d’étain déposée en 10 min pour une densité de courant de
400 A.m–2sur une surface de 10 cm2 d’électrode.
Données:
Ÿ Potentiels standard redox E°(en V).
Sn2+/Sn(S) : E° = –0,14 V; Sn4+/Sn(S) : E° = +0,005 V ; Ag+/Ag(S) : E° = +0,80 V ;
Fe2+/Fe(S) : E° = –0,44 V ; H2O/H2(G) : E° = 0,00 V ; O2(G)/H2O : E° = 1,23 V.
Ÿ Surtensions cinétiques:
Sur étain : Sn2+/Sn(S) rapide ; Ag+/Ag(S) rapide ; H2O/H2(G) : -1 V ; O2(G)/H2O : +1 V.
Sur plomb : Sn4+/Sn(S) rapide ; Ag+/Ag(S) rapide ; H2O/H2(G) : –1 V .
Sur fer : H2O/H2(G) : –0,6 V .
Sur aluminium : O2(G)/H2O : +0,7 V.
Ÿ Constantes physiques :
e = 1,6×10-19 C; R = 8,314 J.K-1.mol-1 ; NA = 6,02×1023 mol-1 ; 2,3×RT/F = 0,06 V.
Partie II
SUPRACONDUCTIVITE DE L’ETAIN
Le 28 avril 1911, en étudiant la résistivité électrique des métaux à basses températures, le
physicien hollandais Karmelingh Onnes constate que le mercure, à une température un peu
inférieure à celle de l’hélium liquide bouillant à la pression atmosphérique, semble avoir une

Spé ψ 2004-2005 page 2/4 Devoir n°5
résistance tellement faible que ses appareils sont incapables de la détecter. Le 27 mai de la même
année, il constate qu’en fait la résistance électrique du mercure chute brusquement à partir d’une
valeur de température donnée au lieu de continuer à diminuer progressivement. En décembre 1912,
il trouve que le plomb et l’étain ont eux aussi la même propriété. Karmelingh Onnes vient de
découvrir la supraconductivité des métaux. (En 1913, Karmelingh Onnes obtint le prix Nobel de
Physique pour ses travaux.)
Cette partie examine quelques propriétés des supraconducteurs du seul point de vue de la
magnétostatique. Au passage, il met en évidence celles de ces propriétés qui correspondent à celles
des conducteurs parfaits. On donne µ0 = 4π×10–7 H.m–1.
II-A-1) On considère la superposition d’un champ uniforme Βa = BaeZ et
du champ BM créé par un dipôle magnétique de moment M placé à l’origine des
coordonnées qui s’écrit, au point P repéré par ses coordonnées sphériques
r, θ, ϕ. B B M r r M
M M
( ) ( , , ) .
P r r r
= = −
R
S
T
U
V
W
θ ϕ µπ
05 3
4
3
b
g
avec r = OP.
M et Ba sont reliés par M e= −
F
H
G
I
K
J
23
0
π
µRBa Z où R est une longueur
donnée. a) Expliciter, pour cette valeur de M, le champ BR = Ba + BM en
fonction de Ba, R, r, θ, er et eZ.
b) Calculer le produit scalaire BR.rer en un point quelconque.
c) En déduire que BR est tangent à la sphère de rayon R et de centre O en chacun de
ses points. Où l’intensité du champ au voisinage immédiat de la sphère est-elle maximale ?
d) Donner un tracé approximatif des lignes de champ de BR à l’extérieur de cette
sphère.II-A-2) On considère la nappe surfacique de courant
JS(r, θ, ϕ)eϕ = J0sin(θ) si r = R
JS(r, θ, ϕ) = 0 sinon.
a) Déterminer a priori la direction du champ B(O) créé par la distribution au centre
de la sphère. b) Calculer ce champ B(O). Dans la suite, on admettra que le champ créé par la
distribution prend en tout point intérieur à la sphère la même valeur qu’au centre.
Donnée : sin ( )
3
0
4
3
θ θ
πd=
z
.
c) Quel est le moment magnétique dM(θ) d’une tranche de la distribution de courant
comprise entre les angles θ et θ + dθ ?
d) Calculer le moment magnétique total MS de la nappe de courant JS(r).
II-B) L’état supraconducteur parfait d’un matériau, obtenu pour une température inférieure
à une température critique TC et pour une intensité du champ magnétique appliqué inférieure à une
valeur critique BC, est caractérisé par B = 0 en tout point intérieur.
Une sphère, remplie d’un matériau à l’état de supraconducteur parfait, est placée dans un
champ magnétique Ba = BaeZ initialement uniforme. L’intersection de cette sphère de centre O et de
rayon R avec le plan z = 0 est appelée cercle équatorial.
II-B-1) En utilisant la forme locale du théorème d’Ampère, montrer que, dans un
supraconducteur parfait en régime stationnaire, le courant volumique est nul.
II-B-2-a) Rappeler la relation vectorielle de continuité de la composante normale du champ
B à la traversée d’une surface séparant deux milieux 1 et 2 (on notera n12 la normale à la surface
orientée de 1 vers 2).
θ
P
r
O
ϕ
eZ er
M

Spé ψ 2004-2005 page 3/4 Devoir n°5
b) En déduire qu’en présence de la sphère supraconductrice (milieu 1) le champ
extérieur est tangent à sa surface en chacun de ses points.
c) Quelle est la propriété correspondante du champ électrique au voisinage d’un
conducteur ?
II-B-3-a) Rappeler la relation vectorielle de discontinuité de la composante tangentielle du
champ B à la traversée de la surface.
b) En déduire qu’il existe sur la surface de la sphère une nappe de courant surfacique
J . c) Quel est le théorème d’électrostatique correspondant pour le champ électrique au
voisinage d’un conducteur ?
II-B-4) On admet que le champ prend à l’extérieur de la sphère, la valeur trouvée dans les
questions II-A-1.
a) Exprimer JS en fonction de Ba, θ et eϕ.
b) En déduire le champ créé dans la sphère par cette distribution. Conclure.
c) A.N. Ba = 1 T. Calculer JSR,π
2
F
H
G
I
K
J.
d) Expliciter le moment magnétique induit MS acquis par la sphère supraconductrice
dans le champ en fonction de Ba et de R.
A.N. : calculer MS pour Ba = 1 T et R = 1 cm .
II-B-5) À température fixée, la supraconductivité cesse si la norme du champ au voisinage
de la surface atteint une valeur critique ||BR|| = BC. Dans l’état normal (non supraconducteur) le
niobure d’étain (Nb3Sn) se comporte comme un conducteur usuel non magnétique. Pour le niobure
d’étain à 18 K, BC = 12,5 T.
a) En quel endroit de la surface se produira en premier ce phénomène ?
b) Quel est le courant surfacique critique JC correspondant, dans le niobure d’étain à
18 K ? c) Quel est le champ B1 = B1eZ maximum que l’on peut appliquer sans qu’il se
produise ?
Partie III
ETAMAGE
L’application principale de l’étain est l’étamage. Étamer consiste à déposer une mince
couche d'étain sur une surface métallique. Sur l’acier ou sur le cuivre (ustensiles de cuisine),
l'étamage protège le métal de la corrosion.
Les réponses attendues sont ici essentiellement qualitatives.
III-1) Une boite de conserve en fer blanc est formée d’une tôle de fer recouverte d’une
couche mince continue et étanche d’étain. Comment peut-on réaliser l’étamage du fer ? En
l’absence d’étamage, comment se comporterait une conserve en fer vis à vis d’une solution aqueuse
alimentaire. Expliquer alors le phénomène de gonflement de boite.
III-2) La solution aqueuse alimentaire contient en général des complexants organiques. Dans
ce cas, des ions stanneux éventuels sont complexés ce qui se traduit par une très faible
concentration d’ions libres dans le milieu. On raisonne sur une boite de fer blanc.
a) Expliquer pourquoi en cas de rayure accidentel de la boite mettant à nu le fer sous-
jacent, l’étain joue le rôle d’anode sacrificielle et assure une protection cathodique du fer.
b) En réalité, la corrosion de l’étain s’arrête très vite car il se recouvre d’une couche
superficielle de SnO qui lui évite une attaque en profondeur. De quel phénomène s’agit-il?
Remarque: En plus, la protection intérieure des boites est renforcée par la présence d’un
vernis (blanc de nos jours à base de TiO2).

Spé ψ 2004-2005 page 4/4 Devoir n°5
Partie IV
ROTATION D’UNE SPIRE SUPRACONDUCTRICE
On considère une spire Σ, assimilable à un tore de rayon moyen ρ. Le diamètre
d’une section d’une section est noté 2a (avec a << ρ). Elle est constituée d’étain,
matériau dont la conductivité à la température ambiante est σ = 9,1×106 S.m–1.
On désigne par eX, eY, eZ un repère cartésien. Un diamètre de Σ est articulé de
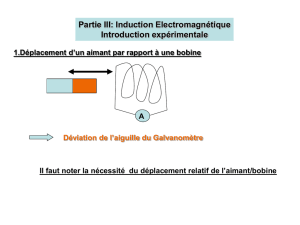
façon cylindrique parfaite autour de eY. Un champ magnétique extérieur crée par un
aimant est uniforme dans la région où Σ peut se déplacer. Il a pour expression BE = B0eX.
La spire est orientée par un vecteur unitaire n perpendiculaire à son plan
et sa position est repérée par l’angle θ entre eX et n.
Pour les applications numériques, on prendra ρ = 5 cm ; a = 0,2 mm ;
B0 = 0,01 T.
IV-1) On étudie la spire à la température ambiante.
a) Calculer littéralement puis numériquement la résistance R de
la spire.
b) On admet que l’inductance propre d’une spire est donnée, si a << ρ, par
La
=
F
H
G
I
K
J−
L
N
M
O
Q
P
µ ρ ρ
08 7
4
ln
Calculer numériquement l’inductance de la spire Σ et commenter le résultat.
c) Calculer la grandeur τ =
L
R
. Quelle est la dimension de cette grandeur et sa
signification physique ?
d) Calculer la grandeur Φ
0
2
0
=πρ B. Quelle est la dimension de cette grandeur et sa
signification physique ?
IV-2) Σ est plongée dans un bain d’hélium liquide et perd toute résistance mesurable. Elle
est initialement dans une position définie par θ = 0. Dans cet état, elle n’est le siège d’aucune f.e.m.
et elle n’est parcourue par aucun courant. Un opérateur extérieur effectue de façon quasistatique une
rotation de la spire d’un angle θ jusqu’à θΜ =
π
2
.
a) Calculer l’intensité i(θ) au cours de l’opération et analyser son évolution à l’aide
de la loi de Lenz.
b) Donner la valeur littérale puis numérique du maximum I0 de i(θ). Quelle serait la
puissance qui serait dissipée un courant d’intensité I0 si la spire était à température ambiante.
Commenter.
c) Calculer numériquement la quantité
W
LI
0 02
1
2
=. Quelle est la dimension de cette
grandeur et sa signification physique ?
d) Calculer l’intensité BP du champ magnétique propre crée par la spire en son centre
dans la position finale θΜ =
π
2
. Comparer BP et B0. Commenter.
e) En déduire en fonction de θ et des données le moment du couple exercé par
l’opérateur sur la spire. Calculer la valeur maximale Γ0 de ce moment au cours de l’opération
réalisée.
f) Calculer le travail WOP fourni par l’opérateur pour faire passer la spire de θ = 0 à
θ
π
=
2
.
g) Faire le bilan énergétique de l’évolution décrite.
2a
ρ
eY
BE
n
θ
eX
eY ¤
Σ
1
/
4
100%