Chaleurs Molaires : gaz monoatomique et biatomique

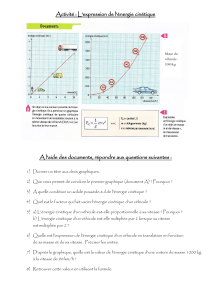
Théorie classique de la capacité calorifique des gaz
parfaits
D’après Sivoukhine, D., (Cours de physique générale, Tome II : Thermodynamique et
Physique moléculaire)
La théorie classique de la capacité calorifique d’un gaz se fonde sur l’hypothèse que les lois
de la mécanique newtonienne sont applicables aux systèmes atomiques et moléculaires.
Comme en réalité le domaine de validité de la mécanique newtonienne est dans ce cas limitée,
la théorie classique n’a pas pu donner une solution parfaitement satisfaisante à ce problème et
fut remplacée plus tard par une théorie quantique. Néanmoins, dans de nombreux cas, la
théorie classique conduisait à des résultats qui étaient conformes aux résultats expérimentaux.
La raison de ce succés de la théorie classique se résume à quelle constitue un cas limite
approché de la théorie quantique et a donc un domaine de validité déterminé.
Aux systèmes classiques s’applique le théorème de l’équipartition de l’énergie cinétique
suivant les degrés de liberté. En s’appuyant sur ces théorèmes on peut élaborer une théorie
classique de la capacité calorifique des gaz et des corps solides. Commençons par la capacité
calorifique des gaz. De la loi de Mayer, nous pouvons montrer que pour les gaz parfaits
**
,
11
vp
R
R
CC
γ
γγ
==
−−
Où
γ
est la constante adiabatique qui peut être déterminée expérimentalement. Il s’ensuit que
pour confronter les résultats théoriques et expérimentaux il suffit de comparer les valeurs
expérimentaux et théoriques de
γ
.
L’énergie interne d’un gaz se compose de l’énergie cinétique des mouvements de translation,
de rotation et du mouvement interne des molécules et des atomes et de l’énergie potentielle de
leurs interactions. Dans le cas des gaz parfaits, où toutes les forces moléculaires sont
négligeables, on peut négliger l’énergie potentielle d’interaction des molécules.
Chaleur massique molaire des gaz monoatomiques
Assimilons les molécules d’un gaz monoatomique à des points matériels. Ceux-ci ne peuvent
exécuter que des mouvements de translation et la totalité de l’énergie interne du gaz se réduit
à l’énergie cinétique des mouvements de translation des atomes. L’énergie cinétique d’une
mole est alors égale à
*
32URT=
On en tire la chaleur molaire à volume constant :
*11
312,5
2
vdU
CRJKmole
dT −−
== ≈
Et, à pression constante
*11
520,8
2
pv
CCR R JKmole
−
−
=+= ≈
Et la constante adiabatique

51, 67
3
p
v
C
C
γ
===
Chaleur molaire des gaz biatomiques
Le modèle de molécule des gaz biatomiques se présente sous forme de deux points matériaux
1 et 2 (figure 1). Ce modèle ressemble à un haltère. Pour fixer sa position dans l’espace il
suffit de connaître cinq coordonnées indépendantes. La position du premier point matériel est
définie par trois coordonnées rectangulaires x1, y1, z1, la position de l’autre point est définie
par x2, y2, z2. Ces six coordonnées ne sont pas toute indépendantes puisqu’elles doivent
satisfaire à la relation
()( )()
222
2
21 21 21 12 .
x
xyyzzLconst−+−+−==
exprimant le fait que la distance entre les deux atomes (deux points), L1,2, reste constante. Il
ne subsiste que cinq coordonnées indépendantes et la molécule possède cinq degrés de liberté.
Figure 1 : représentation schématique d’une molécule biatomique.
L’énergie cinétique de la molécule se compose de l’énergie cinétique du mouvement de
translation de son centre de masse et de l’énergie cinétique de rotation autour du centre de
masse. Alors, en théorie classique l’énergie interne d’une mole de gaz biatomique est donnée
par l’expression
*
52URT=
On en déduit
*11
520,8
2
vdU
CRJKmole
dT −−
== ≈
*11
729,1
2
pv
CCR R JKmole
−
−
=+= ≈
71, 4
5
p
v
C
C
γ
===
1
/
2
100%