La régulation intracellulaire de la protéine précurseur du peptide β

©2003 Successful Aging SA
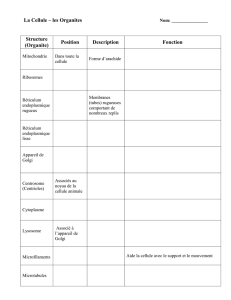
La maladie d’Alzheimer est caractérisée par une
production excessive et une accumulation de peptides β-
amyloïdes. Ceux-ci sont formés à partir d’une protéine
précurseur (βAPP) synthétisée dans le réticulum
endoplasmique et transportée dans l’appareil de Golgi. Des
vésicules de sécrétion, originaires de l’appareil de Golgi,
transportent la protéine précurseur au niveau de la membrane
cellulaire où elle peut être clivée pour produire une protéine
soluble, la sβAPP, ou réinternalisée par des vésicules à
clathrine et être alors soumise à une dégradation lysosomiale.
Le trafic entre l’appareil de Golgi et la membrane cellulaire
détermine donc la destinée de l’amyloïde, sous forme de
sβAPP ou de β-amyloïde.
Les présénilines (PS1 et PS2) sont des protéines
transmembranaires qui s’associent avec d’autres protéines de
membrane pour former des complexes de haut poids
moléculaire. Ces complexes joueraient un rôle essentiel dans
le clivage des protéines, dont la βAPP. Des modifications
génétiques dans l’expression de la βAPP ou des présénilines
conduisent à une augmentation de la production de β-
amyloïde et peuvent induire l’apparition précoce de la forme
familiale de la maladie d’Alzheimer (FAD). Le niveau
d’intervention des présénilines n’est pas encore connu avec
précision. Pour explorer leur fonction, les auteurs ont utilisé
des cultures de cellules (de neuroblastomes et de
fibroblastes), manipulées génétiquement, dans lesquelles ils
identifient par marquage la production de β-amyloïde et le
trafic de βAPP et de β-amyloïde dans le réticulum et
l’appareil de Golgi. L’étude faite sur ces cellules ainsi
conditionnées donne les conclusions suivantes :
- Une déficience en PS1 induit une augmentation du transport
de βAPP du réticulum vers le Golgi et du Golgi vers la
membrane cellulaire.
- Lorsque la PS1 n’est pas exprimée, le trafic de la βAPP à
partir du réticulum est accéléré et sa quantité augmente au
niveau de la membrane cellulaire ; cette augmentation n’est
pas liée à une modification de la formation des vésicules
golgiennes.
- Lorsque l’expression de la PS1 est liée au pattern FAD, le
trafic de la βAPP est retardé et sa quantité diminue au niveau
de la membrane. L’apport de βAPP au niveau de la
membrane est ainsi drastiquement réduit au niveau des
axones et de leurs terminaisons.
L’ensemble des résultats indiquerait donc que l’action de
la PS1 dépasse une simple fonction catalytique dans le
clivage de la βAPP. Elle pourrait réguler le métabolisme de la
βAPP en altérant son trafic. Elle constituerait ainsi un facteur
de rétention dans le processus de guidage et de transport de la
βAPP vers le compartiment où le clivage se produit.
Ph. van den Bosch de Aguilar
Université Catholique de Louvain, Louvain-la-Neuve
La régulation intracellulaire de la protéine précurseur du
peptide β-amyloïde par la préséniline 1
Cai D, Leem JY, Greenfield JP, Wang P, Kim BS, Wang R, Lopes KO, Kim SH, Zheng H, Greengard P, Sisodia SS,
Thinakaran G, Xu H. Presenilin-1 regulates intracellular trafficking and cell surface delivery of β-amyloid precursor
protein. J. Biol.Chem. 2003, 278: 3446-3454.
Af 114- 2003
1
/
1
100%