Chap 7F - TP n°17 - Activité Pauling

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°17 : transformations en chimie organique Page 1 / 4
TP de Sciences Physiques nÀ17 : activité documentaire
Transformations en chimie organique
Activité n°1 : électronégativité de Pauling et polarisation d’une liaison covalente
Linus Pauling a établi le lien entre la polarisation d’une liaison et l’électronégativité de chacun des deux atomes
engagés dans cette liaison.
1/ Pauling, un scientifique hors du commun
L'Américain Linus Cari Pauling (1901–1994) est l'un des plus grands scientifiques du
XXème siècle. Décrit également comme l'un des plus grands penseurs et visionnaires du
millénaire avec Galilée, Newton et Einstein, Pauling a apporté sa contribution dans des
domaines aussi divers que la mécanique quantique, la chimie organique et inorganique, la
biochimie, la biologie moléculaire et la médecine. En 1952, Albert Einstein disait de lui : «
Professor Pauling is one of the most prominent and inventive scientists in this country. I
have the highest esteem for his character and for his reliability as a man and as a citizen. »
Pauling est le seul à recevoir, dans deux catégories différentes, deux prix Nobel sans les partager avec aucune
autre personne : prix Nobel de Chimie en 1954 « for his research into the nature of the chemical bond and its
application to the elucidation of the structure of complex substances » et prix Nobel de la Paix en 1962, pour sa
lutte pacifiste contre la prolifération des armes nucléaires. Il manque de peu la découverte de la structure de
l’ADN, en proposant à tort un modèle en triple hélice. La structure exacte est proposée par James Watson et
Francis Crick en 1953, ce qui leur vaut le prix Nobel de Médecine en 1962.
2/ Électronégativité de Pauling
Ses travaux sur la nature de la liaison chimique aboutissent à l'ouvrage « The
Nature of the Chemical Bond » en 1939, l'un des plus importants livres de chimie
jamais publiés, cité plus de 16000 fois dans les trente années qui ont suivi sa
première édition. De nombreux articles scientifiques y font encore référence en ce
début du XXI
e
siècle.
Pauling y développe la notion d'électronégativité, grandeur sans dimension, qui
traduit la tendance d'un atome à attirer à lui les électrons de la liaison dans
laquelle il est engagé. L'électronégativité évolue selon la position des éléments
chimiques dans la classification périodique. Pauling a dans un premier temps bâti
une échelle en attribuant la valeur 0,0 à l'hydrogène (figure en bas), puis dans un
second temps a établi une nouvelle échelle d'électronégativité (ci-contre). Parmi
les différentes échelles d'électronégativité existantes, la plus couramment utilisée
par les chimistes à l'heure actuelle reste l'échelle de Pauling (page suivante).
3/ Polarisation d'une liaison
La différence d'électronégativité entre deux atomes s'avère être la
grandeur la plus pertinente pour prédire la polarisation d'une liaison.
Pauling s'est intéressé à la compréhension du rapport entre deux
types de liaisons :
dans la liaison covalente apolaire (non polarisée ou non polaire),
les électrons sont mis en commun et équitablement répartis entre
deux atomes (cas de deux atomes identiques ou ayant une
différence d'électronégativité faible, inférieure à 0,3).
dans la liaison ionique, les électrons sont transférés d'un atome à l'autre (cas de deux atomes ayant une
différence d'électronégativité très forte, supérieure à 2,0), Dans ce cas, les deux atomes deviennent des ions.

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°17 : transformations en chimie organique Page 2 / 4
Pauling a montré que ces deux types de liaison sont en réalité des cas « limites » et que la plupart des liaisons sont
en fait un mélange de liaison covalente « pure » et de liaison ionique « pure ». On parle alors de liaison covalente
polarisée (ou polaire) entre deux atomes A et B, lorsqu'elle relie deux atomes ayant une différence
d'électronégativité moyenne à forte. Le doublet d'électrons mis en commun n'est alors pas réparti de manière
symétrique entre les deux atomes :
l'atome le plus électronégatif A porte un excès de charge négative, noté δ-.
l'atome le moins électronégatif B porte un défaut de charge négative, noté δ+.
Les charges δ- (delta -) et δ+ (delta +) sont des charges « partielles », fractions de la charge électrique élémentaire
notée « e » (e = 1,6 × 10
-19
C).
Pistes de réflexion
1a/ Hormis Pauling, quelle personnalité a reçu deux prix Nobel (dont un partagé) dans deux catégories différentes ?
1b/ Pour quels travaux de recherche Pauling a-t-il reçu le prix Nobel de Chimie en 1954 ?
1c/ L'ADN fait partie des « molécules complexes » sur lesquelles Pauling a travaillé. Quelle erreur a-t-il commise
en proposant une structure en triple hélice ?
2a/ Par quelle opération Pauling est-il passé de l'ancienne échelle à la nouvelle échelle d'électronégativité ?
2b/ Quel intérêt peut-on trouver à ce changement d'échelle quant au signe de l’électronégativité des éléments
chimiques ?
3a/ Hormis le francium (Fr), élément radioactif rare, quel est l'élément chimique d'électronégativité la plus faible ?
Et la plus forte ?
3b/ Comment évolue l'électronégativité lorsqu'on se déplace le long d'une ligne de la classification périodique ? Et
le long d'une colonne ?
3c/ Pourquoi le tableau ci-dessus ne fait-il pas apparaître les valeurs d'électronégativité pour les premiers éléments
de la famille des gaz rares ?
3d/ Quelle place particulière occupe l'élément carbone dans l'échelle d'électronégativité de Pauling ?
4a/ Calculer la différence d'électronégativité entre les deux atomes mis en jeu dans les liaisons H – H et C – H.
Ces liaisons sont-elles polarisées ?
4b/ Calculer la différence d'électronégativité entre le sodium et le fluor. Quel type de liaison est mis en jeu dans
NaF
(s)
?
4c/ Étant donné la place du carbone dans l'échelle d'électronégativité, pourquoi la liaison ionique est-elle rare dans
les composés carbonés ?
Pour conclure
Calculer la différence d'électronégativité entre les deux atomes mis en jeu dans les liaisons suivantes, puis prévoir
leur polarisation, en faisant apparaître les charges partielles δ- et δ+
C – O C – N O – H N – H H – Cl

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°17 : transformations en chimie organique Page 3 / 4
Activité n°2 : mouvement d’un doublet d’électrons
La description microscopique des transformations chimiques nécessite l’utilisation de modèles permettant de
représenter les doublets d’électrons et leur mouvement.
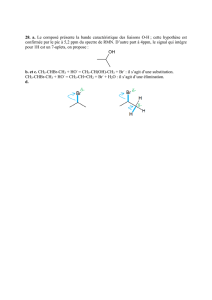
1/ Le modèle de Lewis
Dans la représentation de Lewis d'une espèce chimique, les atomes usuels vérifient la règle du duet ou de l'octet,
en s'entourant d'un ou de quatre doublets d'électrons. Lorsque l'atome ne porte pas de charge, la répartition des
doublets liants et non liants autour de cet atome est donnée dans le tableau suivant :
Atome H C N O Cl
Nbre de doublets liants 1 4 3 2 1
Nbre de doublets non liants 0 0 1 2 3
Lorsque l'atome porte une charge, la répartition est différente :
- un atome qui perd un doublet liant et gagne un doublet non liant porte une charge entière négative, symbolisée
par – (figure 1a).
- un atome qui perd un doublet non liant et gagne un doublet liant porte une charge entière positive, symbolisée
par + (figure 1b).
- les atomes C et H peuvent perdre un doublet liant (ils ne vérifient donc plus la règle de l'octet et du duet). Ils
portent alors une charge + (figure 2c).
Fig. 1 : représentations de Lewis
(a) de l'ion chlorure Cl
-
(b) de l'ion ammonium NH
4+
(c) de l’ion H
3
C
+
.
2/ Le modèle de la flèche courbe
En se basant sur des observations expérimentales, les chimistes élaborent un mécanisme réactionnel qui décrit
dans le détail, et à l'échelle moléculaire, le déroulement de chaque étape d'une transformation chimique, en
particulier la nature des liaisons formées et rompues, et l'ordre dans lequel se font ces formations et ces ruptures.
Lors de chaque étape, la formation (Fig. 2a) et/ou la rupture (Fig. 2b) de liaisons sont la conséquence du
déplacement d'un ou plusieurs doublet(s) d'électrons, représenté par le modèle de la flèche courbe. La flèche
courbe part d'un doublet d'électrons liant ou non liant et pointe vers un site déficient en électrons.
Fig. 2 : (a) formation d’une liaison O – C
(b) Rupture d'une liaison C – C et formation
d'une liaison C – H.
L'arrivée d'une flèche sur un atome déclenche souvent le départ d'une autre flèche (Fig. 4).
Fig. 3 : étape mettant en jeu deux déplacements
de doublets.

Terminale S www.sciencesphysiques.info
TP de Sciences Physiques n°17 : transformations en chimie organique Page 4 / 4
Pistes de réflexion
1/ Pour chaque représentation de la figure 1, justifier la charge portée par les atomes Cl, N et C en faisant le
décompte des doublets liants ou non liants entourant ces atomes.
2/ Donner la représentation de Lewis des espèces chargées : H
+
; H
-
; HO
-
; H
3
C-CO
2-
; Br
-
; H
3
CO
-
; NH
2-
.
3a/. En se référant au tableau de l'activité 1, calculer la différence d'électronégativité entre les deux atomes mis en
jeu dans la liaison C = O, puis prévoir sa polarisation.
3b/ En déduire ce qui, au sein de cette liaison, permet d'expliquer le sens du déplacement du doublet d'électrons
modélisé par la flèche 1 de la figure 3.
4a/ Réécrire l'étape de la figure 3 en ne représentant que le déplacement modélisé par la flèche 1.
b. Dans l'espèce formée dans ce cas, quelle est la charge portée par l'atome de carbone central ?
c. Cet atome respecte-t-il la règle de l'octet ?
d. En déduire pourquoi l'arrivée de la flèche 1 sur l'atome de carbone déclenche le départ de la flèche 2.
5/ Quelle peut être la nature initiale (liant ou non liant) du doublet d'électrons qui se déplace lors d'une étape de
formation de liaison ? Et lors d'une étape de rupture de liaison ?
Activité n°3 : les grandes catégories de réaction
Dans une démarche de rationalisation, la majorité des réactions à disposition des chimistes sont réparties entre
quelques catégories.
1/ Des règles communes à tous
L'Union internationale de chimie pure et appliquée (en anglais « International Union of Pure and Applied
Chemistry », IUPAC) est une organisation non gouvernementale qui s'intéresse aux progrès de la chimie dans tous
les domaines.
Elle est reconnue en particulier pour le développement de définitions et de règles visant à limiter les ambiguïtés et
les malentendus dans les discussions au sein de la communauté scientifique. Par exemple, la nomenclature IUPAC
sert à nommer les espèces chimiques de façon univoque et systématique à partir de leur structure.
2/ Déterminer des catégories de réaction
À partir de l'examen des réactifs et des produits principaux, la plupart des réactions de chimie organique sont
classées dans une des catégories suivantes définies par l'IUPAC : addition, élimination et substitution.
Le document suivant présente un exemple pour chacune de ces catégories.
CH
3
– Cl + HO
-
→ CH
3
– OH + Cl
-
Substitution
CH
3
– CH
2
– CH
2
– OH → CH
3
– CH = CH
2
+ H
2
O Elimination
CH
3
– C – CH
2
– CH
3
+ H
2
→ CH
3
– CH – CH
2
– CH
3
Addition
| | |
O OH
Pour chacun des trois exemples de réactions proposés :
1/ Identifier le réactif et le produit principaux et construire leurs modèles moléculaires.
2/ Comparer les deux molécules : quels atomes ou groupes d'atomes ont été supprimés, ajoutés ou remplacés lors
de la réaction ?
3/ Représenter les molécules à l'aide de formules semi-développées et entourer ces différences.
4/ Proposer une définition de l'addition, de l'élimination et de la substitution. On pourra considérer en particulier :
- si un atome, des atomes ou un groupe d'atomes se lient à la molécule étudiée au cours de la réaction;
- si un atome, des atomes ou un groupe d'atomes sont ôtés de la molécule étudiée.
1
/
4
100%