File - L2 Bichat 2012-2013

1 / 14
Le 13 Novembre 2012
10h30-12h30
UE3 – Pharmacologie
Ronéotypeur : Cyrille Monin
Ronéolecteur : Pierre Delzongue
COURS N°11 :
Thérapeutique individualisée et nouveaux médicaments
La prof n'a pas voulu nous passer ses diapos, elle a promis d'en envoyer une version
épurée à une personne qui lui avait donné son mail (mais visiblement pas avant les
partiels ^^ ). Je n'ai donc pas pu vous mettre certains schémas.

2 / 14
Table des matières
I. Introduction ...................................................................................... 3
II. Les thérapies ciblant les tyrosines kinases. ............................... 3
1) Généralités ................................................................................................... 3
2) Premier exemple: le cancer du sein. .......................................................... 4
3) Deuxième exemple: la leucémie myéloïde chronique. ............................. 4
4) Autres utilisations de l'Imatinib. ................................................................ 6
III. Les thérapies ciblant l'environnement de la tumeur. ........... 7
1) L'angiogenèse tumorale ............................................................................. 7
2) Les anti-angiogéniques .............................................................................. 8
IV. Dernières thérapeutiques, limites, perspectives .................... 9
1) Thérapies ciblées dans le mélanome. ....................................................... 9
2) Le traitement personnalisé en France. .................................................... 10
3) Limites des thérapies ciblées: les résistances. ...................................... 11
Conclusion: ......................................................................................... 13

3 / 14
I. Introduction
Lorsqu'on parle de thérapie ciblée, il faut d'abord définir les différentes cibles possibles.
Il peut s'agir d'un tissu pathologique, ou de l'environnement de ce tissu (en particulier
dans les cancers). On peut également cibler un sous-groupe de la pathologie, (on verra
ainsi des traitements spécifiques de sous-catégories du cancer du sein) ou encore une
molécule altérée responsable d'une altération physiopathologique (on parle donc de
biomarqueur) et donc d'un ciblage thérapeutique.
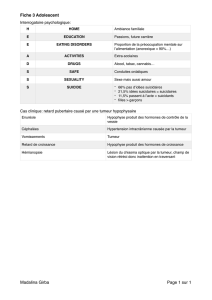
On va beaucoup parler de tumeurs, il faut donc se rappeler des moyens de diagnostiquer
et caractériser un cancer: la taille de la tumeur, l'invasion métastatique, l'état du ganglion
sentinelle, l'ulcération, sont des critères cliniques et pathologiques. Aujourd'hui, on a
dépassé ce stade et on sait faire des caractérisations moléculaires: on fait des
cartographies d'ARN tumoral, via le screening, et on trouve ainsi les gènes sous et
surexprimés, les gènes mutés responsables ou marqueurs de la tumeur. De même, on
utilise l'immunohistochimie pour étudier l'expression des protéines.
II. Les thérapies ciblant les tyrosines kinases.
1) Généralités
Les récepteurs membranaires à tyrosine kinase sont extrêmement variés. Ils sont altérés
dans de nombreuses pathologies (en particulier les cancers) et on va chercher à bloquer
ces altérations pour guérir le malade.
On prend l'exemple d'un récepteur EGFR constitutivement activé, et on remarque qu'il y
a de nombreuses cibles potentielles. On peut cibler le ligand, le récepteur lui-même en
bloquant son activité soit à l'extérieur soit à l'intérieur de la cellule. En intra-cellulaire, on
peut également bloquer un des médiateurs de la cascade induite par l'activation du
récepteur, ou même aller bloquer encore plus en aval et cibler directement au niveau du
noyau, des protéines et des biomarqueurs activés quand le récepteur l'est. On peut donc
tout cibler, du début à la fin de la chaine, tout en sachant que plus on sera proche de
l'altération, plus le traitement sera spécifique de la maladie (par exemple si on cible Ras,
activé via de très nombreux récepteurs, le traitement ne sera absolument pas
spécifique).
Concernant les traitements ciblant les
récepteurs, on peut en faire des spécifiques
(seul un récepteur est ciblé) ou polyvalents (on
touche toute une famille de récepteurs). Si on
regarde à nouveau les récepteurs à Tyrosine
kinase, on peut s'intéresser plus spécifiquement
à un type de récepteur, par exemple erb. On

4 / 14
remarque alors qu'il se divise en différents sous-types de récepteurs, et que les voies de
signalisation des différents récepteurs de cette famille erb sont très liées. Il est donc très
difficile de faire un traitement spécifique d'un récepteur, car il existe de nombreux
récepteurs dont la structure ressemble à la sienne et utilisant les mêmes médiateurs. On
voit ainsi que l'activation du récepteur à l'EGFR entraine l'activation de FAK, qui lui-
même active différentes voies, et que les autres récepteurs peuvent eux aussi interagir
avec cette cascade de signalisation. On a donc un enchevêtrement de réseaux de
signalisation, ce qui fait qu'il est très difficile de cibler une seule voie.
2) Premier exemple: le cancer du sein.
La protéine HER2 est surexprimée dans des cancers du sein. Elle ne le sera pas dans
tous les cancers du sein, mais seulement dans certains sous-types d'entre eux. Seul 15
à 20% des cancers du sein surexpriment HER2 (on le voit avec un marquage en
immunohistochimie). Au début, on a pensé que cette sous-population pourrait être traitée
par des traitements ciblés, bloquant ce récepteur présent en trop grande quantité.
Pour commencer, on a développé un anticorps monoclonal (donc la DCI du médicament
se termine par le suffixe -mab, pour monoclonal antibodie), le trastuzumab (nom
commercial: Herceptin), qui se fixe en extracellulaire aux récepteurs HER2 et empêche
leur dimérisation, ce qui bloque leur activation en intracellulaire. Ce médicament, seul, a
entrainé une réponse dans 15 à 20% des cancers du sein, et est actuellement utilisé en
première ligne, mais uniquement pour cette fraction des malades qui surexpriment HER2
(il est inefficace chez tous les autres). Aujourd'hui, on l'utilise toujours en première ligne,
combiné à une chimiothérapie.
3) Deuxième exemple: la leucémie myéloïde chronique.
Cette leucémie représente environ 20% de l'ensemble des leucémies, et chaque année
on observe 1 à 2 cas pour 100 000 personnes. Cette leucémie est liée à l'activation d'une
protéine de fusion qu'on appelle BCR-ABL (BCR- Abelson). Explication du
phénomène: le chromosome 9 porte au niveau de son bras long une protéine ABL,
tandis que le chromosome 22 porte une protéine BCR. Dans la LMC, une translocation
conduit à la fusion des deux brins libres de ces chromosomes, et on aboutit à une
protéine de fusion, associant les deux protéines ABL et BCR. BCR-ABL est une kinase,
constitutivement active, qui est responsable de cette leucémie, elle en signe le
diagnostic.
Etant constitutivement active, la kinase BCR-ABL va constamment phosphoryler sa cible,
GRB2, laquelle active Ras, ce qui va entrainer une prolifération de la cellule par les
mécanismes que l'on connait (la célèbre voie des MAPK), et on obtient une cellule qui va
se multiplier de façon permanente, incontrôlée. On a donc cherché à bloquer cette
protéine de fusion, et on a fait un développement clinique portant sur la protéine STI571,

5 / 14
ou plus particulièrement le Glivec, ce qui a
révolutionné le traitement de la LMC (concernant
les noms: la DCI du médicament est l'Imatinib,
commercialisée sous le nom de Glivec et encore
appelé parfois STI571). Cette protéine se place
dans une poche de BCR-ABL, où se fixe
normalement l'ATP qui sert à phosphoryler le
substrat. Le Glivec bloque donc l'accès de cette
poche à l'ATP, et ainsi l'activation de cette kinase.
On nous présente ensuite les résultats de l'essai d'enregistrement de l'Imatinib. C'est
l'essai final qui a donné sa validation à la molécule pour être enregistrée par les
instances réglementaires, puis utilisée en clinique. On a donc comparé le traitement de
référence du moment (ici IFN-alpha + cytarabine) dans deux groupes de 553 patients
avec randomisation et double-aveugle. Au milieu de l'essai, on a procédé à un
crossover, c'est-à-dire que tous les patients ont été traités successivement par les deux
traitements, ils sont changés de groupe en cours d'étude. La majorité a d'abord été traité
par l'IFN, et on a inversé au milieu de l'étude.
Ça c'est ce que la prof a dit, mais bien
sûr ça ne correspond absolument pas au
graphique (on a 553 patients par groupe,
et pas 359 dans l'un et 14 dans l'autre).
Pour ceux qui aimeraient comprendre
cette diapo un rien obscure, voici une
petite explication d'après diverses
informations trouvées sur Internet: sur les
553 patients dans le groupe traité à
l'Imatinib, 14 sont passé dans l'autre
groupe, 364 ont poursuivi l'Imatinib
jusqu'au bout et 175 ont quitté l'étude (parce qu'ils sont morts de leur maladie ou qu'ils
n'ont pas supporté le traitement). Pour le groupe IFN, 13 ont poursuivi le traitement, 181
ont abandonné et les autres sont passés dans le groupe Imatinib pour pouvoir continuer
l'étude (on s'est douté qu'ils allaient mourir sinon...). Les résultats finaux s'intéressent
uniquement aux patients qui restent dans leur groupe ou qui abandonnent l'étude: 66%
restent avec l'Imatinib contre 2% pour l'IFN.
On a également observé les réponses cytogénétiques et
hématologique: est-ce qu'il reste encore de la protéine de
fusion chez les patients? On voit que 98%, 92 et 86% des
patients ont bien eu une réponse cytogénétique et biologique
là encore ce n'est pas tout à fait ça, un petit pourcentage
n'ayant qu'une réponse hématologique. Il est très rare d'obtenir
de telles courbes, en général les résultats sont moins bons.
Bcr-Abl
ATP
Substrat
STI571
Bcr-Abl
Substrat
P
P
P
PSubstrat
Effecteur
Inactive form
Active form
Bcr-Abl
ATP
Substrat
STI571
Bcr-Abl
Substrat
P
P
P
PSubstrat
Effecteur
Inactive form
Active form
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%