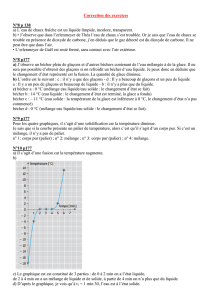
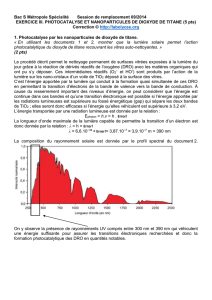
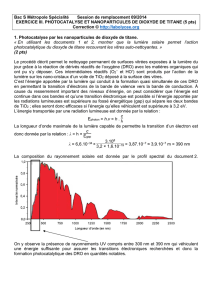
HYDRAZINE, ACIDE ACÉTIQUE GLACIAL, ACIDE 3

Chimie organique Cahier de laboratoire 15
EXPÉRIENCE 4!: SYNTHÈSE DU LUMINOL (3-AMINOPHTHALHYDRAZIDE)
Travail individuel
Durée deux semaines
SIMDUT: HYDRAZINE, ACIDE ACÉTIQUE GLACIAL, ACIDE 3-NITROPHTALIQUE,
TRIÉTYLÈNE GLYCOL
Théorie
Le luminol est un composé organique servant à détecter les traces de sang lavés
sur les scènes de crime. Toute investigation policière, sur un lieu où un crime a été
commis, repose sur le fait que rien ne peut être effacé sans laisser de traces. Ceci
est particulièrement vrai pour une tache de sang qui, sans l’utilisation de produits
chimiques spécifiques, et même après lavage, restent sur le lieu du crime pendant des
années, sans que personne ne sans aperçoive. En effet au contact du sang, le luminol
subit une transformation chimique et émet de la lumière. Le luminol produira de la
lumière par une réaction d'oxydo-réduction impliquant les ions fer des globules
rouges du sang. Ce processus connu sous le nom de chimiluminescence est le même
phénomène qui permet aux lucioles d’émettre de la lumière.
En solution neutre, le luminol existe sous forme de zwittérion (Composé neutre
possédant en nombre égal des charges électriques formelles d’une unité et de signes opposés). Cet
ion dipolaire montre une fluorescence bleue quand il est exposé à la lumière.
Cependant, en solution basique, le luminol se change en dianion qui peut être oxydé par
une molécule d'oxygène pour donner la chimioluminescence.
Le mécanisme de réaction est le suivant!: L'acide 3-nitrophtalique réagit avec
l'hydrazine pour former le nitrophthalhydrazide qui est un produit intermédiaire de
réaction. Par la suite, par un mécanisme de réduction, le nitrophthalhydrazide réagit
avec l'hydrosulfite de sodium dans de l'eau pour former le 3-aminophthalhydrazide,
communément appelé le luminol (C8H7N3O2).

Chimie organique Cahier de laboratoire 16
Références
Flamand, E. Bilodeau J. Chimie Organique, Expériences de laboratoire. Modulo-
Griffon, Mont-Royal, 106pp. 2003
http://luminol.iquebec.com/
http://chimie.fauriel.org/doc/luminol.html
http://en.wikipedia.org/wiki/Luminol
Procédure
Partie A: Nitrophhtalhydrazide.
1- Placer 3,9 g d'acide 3-nitrophtalique dans un ballon 3 cols de 250 ml
2- Ajouter 6 ml d’une solution à 10% d'hydrazine.
3- Chauffer légèrement avec le chauffe-ballon, jusqu'à ce que le solide se dissolve
complètement.
4- Lorsque le solide est dissous, ajouter 30 ml de triéthylène glycol, deux billes de
verre et placer un bouchon et un thermomètre pour fermer le système.
5- Chauffer la solution jusqu'à 135°C -140°C. Le liquide devrait bouillir vers 120°C.
6- Enlever le chauffe ballon lorsque la température de 135°C -140°C est atteint.
7- Laisser la fiole conique refroidir jusqu'à 100°C sur la table.
8- Pendant ce temps, chauffer, 75 ml d'eau jusqu'à ébullition dans un bécher de
150ml.
9- Quand le ballon est à 100°C, verser les 75 ml d'eau bouillante.
10- Laisser refroidir le ballon jusqu'à l'apparition de cristaux.
11- Placer le ballon et un flacon laveur dans un bain de glace (1 bain de cuivre pour 2
personnes) jusqu'à ce que la température du ballon soit inférieure à 20°C.
12- Peser un bécher de 150 ml identifier à votre nom avec un papier filtre.
13- Filtrer sous vide (utiliser le filtre pesé en 12) en lavant les cristaux avec une
quantité minimale d'eau froide du flacon laveur.
14- Transférer les cristaux et le papier-filtre dans le bécher de 150 ml et placer le
bécher identifié dans la hotte pour une semaine.
Fin du laboratoire

Chimie organique Cahier de laboratoire 17
Partie B: Luminol 3-aminophthalhydrazide
15- Peser le bécher de 150 ml contenant le papier filtre et le nitrophhtalhydrazide,
calculer le rendement
16- Déterminer le point de fusion si possible du nitrophhtalhydrazide.
Effectuer les manipulations suivantes sous la hotte.
17- Gratter le produit du filtre.
18- Ajouter au bécher de 150 ml, 20 ml d’une solution d'hydroxyde de sodium à 10%
et 12,5 g de dithionite dihydrate de sodium.
19- Chauffer en agitant sur la plaque chauffante jusqu'à ébullition. S'il y a lieu,
ajouter de l'eau pour laver le produit solide qui pourrait se trouver coller sur les
parois du bécher. Maintenir l'ébullition pendant 5 minutes.
20- Ajouter ensuite 8 ml d'acide acétique glacial et laisser le bécher refroidir à la
température de la pièce dans la hotte pendant 10 minutes.
21- Placer le bécher et un flacon laveur dans un bain de glace pendant 10 minutes (1
bain de cuivre pour deux personnes).
22- Peser un bécher de 150 ml identifié avec un papier filtre.
23- Filtrer sous vide (avec le filtre peser en 22) les cristaux jaunâtres de luminol en
lavant les cristaux avec une quantité minimale d'eau froide du flacon laveur.
24- Transférer les cristaux et le papier filtre dans le bécher de 150 ml et placer
dans la hotte pour une semaine.
Fin du laboratoire
Partie C: La chimioluminescence
25- Peser le bécher de 150 ml et caractériser le luminol expérimental et le luminol
pur par le point de fusion.
26- Couvrir le fond d'une fiole conique de 125 ml avec une couche d'hydroxyde de
potassium et ajouter 2 ml d'eau.
27- Ajouter 10 ml de diméthylsulfoxide pour couvrir l'hydroxyde de potassium et
0,2g de luminol.
28-Placer un bouchon et agiter vigoureusement pour mélanger de l’air avec la solution.
29- Noter la coloration à la lumière puis dans une chambre noire. L'intensité de la
lumière devrait continuer en agitant et en enlevant puis remettant le bouchon pour
laisser entrer de l’air.
30- Pour observer le transfert d'énergie à un colorant fluorescent, dissoudre
quelques cristaux de colorant (1-5 mg) dans 2-3 ml d'eau.
31- Ajouter cette solution à la solution préparée aux étapes #26 et #27
32- Placer le bouchon et agiter puis observer la couleur produite à la lumière et dans
le noir.
Fin du laboratoire
1
/
3
100%