Chp 6 la classification periodique

Seconde_Thème 1_L’UNIVERS
chapitre 6_La classification périodique des éléments
M.Meyniel 1/4
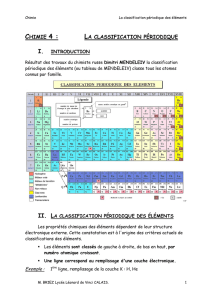
chapitre 6 : LA CLASSIFICATION PERIODIQUE DES ELEMENTS
Tout au long de l’histoire, de plus en plus d’éléments ont été découverts et le sont encore de nos jours.
Il y a donc eu une nécessité de les classer comme en ce fut le cas pour les animaux afin de faciliter leur étude et de
retrouver facilement leurs propriétés. Mais ce classement ne s’est pas fait en une seule fois. On va donc s’intéresser à
l’historique de cette classification avant d’en étudier les propriétés et ses utilités.
Cf Texte sur « Les démarches historiques de classification ».
I. Les démarches historiques de classification.
1. Les premières classifications.
1. Comment caractérisait-on les éléments chimiques au début du XIXe siècle ?
2. Donner la définition d’une triade et donner un exemple cité dans le texte.
3. Le carbone a une masse atomique égale à 12. Qu’est-ce que cela signifie ?
2. La classification selon Mendeleïev.
1. Combien d’éléments chimiques étaient connus à l’époque de Mendeleïev ?
2. Selon quel critère choisit-il alors de classer ces éléments connus ?
3. Dans la classification de Mendeleïev, où retrouve-t-on les éléments appartenant à une même triade ?
4. En vous servant de l’extrait du tableau (Doc. 7), indiquer alors les éléments ayant des propriétés voisines de
celles de l’oxygène. Justifier.
3. Succès et limites de la classification de Mendeleïev.
1. Quelles ont été les deux idées de génie de Mendeleïev qui se sont avérées justifiées par des découvertes
postérieures à ces travaux ?
2. Quelles sont les limites et erreurs (on cherchera à expliquer leur présence) de la première classification
proposée par Mendeleïev ?
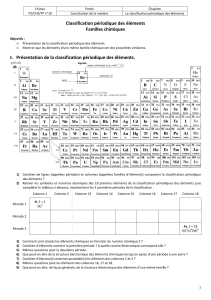
II. La classification actuelle : le tableau périodique.
1. Les critères actuels de la classification.
Actuellement, 118 éléments chimiques sont répertoriés. On utilise une classification périodique faite de
7 lignes et 18 colonnes proche de celle établie par D. Mendeleïev, il y a près de 150 ans. Les erreurs ont été corrigées et
les limites dépassées. Enfin, par commodité, les colonnes sont devenues les lignes que l’on appelle période puisque les
propriétés s’y répètent de façon cyclique et les lignes sont devenues les colonnes correspondant aux familles chimiques
dans lesquelles les éléments présentent des propriétés physiques et chimiques analogues.
LA CLASSIFICATION PERIODIQUE DES ELEMENTS :
I II XIII XIV XV XVI XVII XVIII
1H
2He
3Li
4Be
{10 colonnes}
5B
6C
7N
8O
9F
10Ne
11Na
12Mg
13Al
14Si
15P
16S
17Cl
18Ar

Seconde_Thème 1_L’UNIVERS
chapitre 6_La classification périodique des éléments
M.Meyniel 2/4
1. Que représente le nombre, en indice à gauche, associé au symbole de chaque élément ?
2. Noter dans chaque case, le nom de l’élément chimique correspondant au symbole. Voir tableau au verso.
3. Noter dans chaque case la structure électronique des atomes.
4. Dans quel ordre sont classés les éléments dans la classification périodique ?
2. Utilité et exploitation de la classification.
* Les lignes :
5. Comment appelle-t-on une ligne ?
Quelle particularité électronique présentent les atomes d’une même ligne ?
A quoi correspond alors un changement de ligne ? Mettre en face de chaque ligne, le nom de couche externe.
* Les colonnes :
6. Comment appelle-t-on une colonne ?
Tous les éléments de la dernière colonne, appelés les gaz nobles, sont inertes chimiquement. Tous les
éléments de la 1ère colonne réagissent avec l’eau pour former du dihydrogène H2 et des ions hydroxydes HO-.
Pourquoi les éléments chimiques d’une même colonne présentent-ils des propriétés chimiques voisines ?
Quelle est la particularité de la structure électronique des atomes d’une même colonne ?
Que peut-on dire sur la charge électrique des ions stables que donnent les éléments d’une même famille
chimique ? Justifier et donner des exemples.
Le plus souvent, les familles d’éléments portent le nom du premier élément de la colonne : par exemple, les
éléments de la XVIe colonne appartiennent à la famille de l’oxygène. Cependant, on distingue trois familles
particulières du fait de leur réactivité : les éléments de la 1ère colonne (hormis l’hydrogène qui fait toujours
exception), les éléments de la dernière et ceux de l’avant-dernière colonne de la classification périodique.
En s’attardant sur les éléments concernés, déterminer le nom de ces trois familles.
Rq : * On ne s’intéresse toujours qu’aux 18 premiers éléments ! Si le numéro atomique Z dépasse 18, le classement des
éléments chimiques fait intervenir des critères en plus que ceux énoncés. Les règles énoncées sur l’écriture des structures
électroniques pour les éléments de Z < 18 ne sont plus applicables.
Cependant, les observations expérimentales permettent de généraliser les propriétés chimiques de chaque premier élément de
colonne à tous les autres éléments de sa colonne pour toutes les familles chimiques. Après, il est parfois nécessaire de faire appel
à des connaissances plus fines sur la structure électronique de l’atome en se référant au modèle de Bohr par exemple.
Conclusion : L’Univers présente donc une unité structurale : l’élément chimique. Le grand nombre
de ces éléments a conduit l’Homme à les classifier de façon à faciliter leur étude et leur utilisation. Par
ailleurs, l’Homme en découvre encore de nos jours, qu’ils soient terrestres ou extraterrestres, comme nous
l’avons déjà vu, en exploitant indirectement la lumière des étoiles.
Mais la lumière peut s’utiliser dans bien d’autres domaines que pour étudier l’Univers :
elle est notamment présente dans le domaine de la Santé pour analyser et soigner.
Compétences exigibles
- Utiliser la classification périodique pour retrouver la charge des ions monoatomiques.
- Localiser, dans la classification périodique, les familles des alcalins, halogènes et gaz nobles.

Seconde_Thème 1_L’UNIVERS
chapitre 6_La classification périodique des éléments
M.Meyniel 3/4
1H 2He
3Li 4Be
{10 colonnes}
5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar

Seconde_Thème 1_L’UNIVERS
chapitre 6_La classification périodique des éléments
M.Meyniel 4/4
Exercice 1 : Un atome dans son état fondamental a pour une formule électronique K2L3.
1. a. A quelle période appartient-il ?
b. Donner la formule électronique d’un atome de l’élément situé juste avant lui dans cette période.
c. Indiquer l’ion que donne ce dernier atome en justifiant la réponse.
2. a. A quelle colonne appartient-il ?
b. Donner la formule électronique d’un atome d’élément situé juste en dessous de lui dans la même
colonne.
c. Indiquer l’ion que donne ce dernier atome en justifiant la réponse.
Exercice 2 : Un ion X3- possède 8 électrons sur sa couche externe M dans son état fondamental stable.
1. Ecrire la formule électronique de cet ion. Sa couche externe est-elle saturée ?
2. Déterminer la formule électronique de l’atome X correspondant. En déduire le numéro atomique de cet
élément.
3. Rechercher le nom et le symbole de l’élément dans la classification.
Exercice 3 : Le brome et l’iode appartiennent à la même famille située à la 17ème colonne de la
classification.
1. Comment s’appelle cette famille ?
2. Quel est le nombre d’électrons externes des atomes de cette famille ?
3. Le brome forme avec le phosphore un composé de formule PBr3.
Quelle est la formule du composé que l’iode forme avec le phosphore ?
Et pour votre culture : http://ed.ted.com/periodic-videos
1
/
4
100%