LA CLASSIFICATION PERIODIQUE DES ELEMENTS

CHAPITRE 4
LA CLASSIFICATION PERIODIQUE
ACTIVITE : Approche historique (diaporama)
COURS : La classification périodique
I. Construction de la classification
II. Les familles chimiques
TP : La famille des halogènes

LA CLASSIFICATION PERIODIQUE DES
ELEMENTS
La Terre est constituée d’une centaine d’éléments chimiques en proportions très différentes. L’oxygène, le
silicium, l’aluminium, le fer… sont présents en quantités importantes. Comment ont-ils été découverts ? Peut-
on prévoir leurs propriétés chimiques ?
I. APPROCHE HISTORIQUE : Activité documentaire page 102
Au 19° siècle, la chimie était en pleine évolution. 60 éléments étaient déjà connus, et certains chimistes
avaient déjà repéré des analogies entre plusieurs éléments. Il devint donc nécessaire d'élaborer une théorie
regroupant sous une seule idée maîtresse la diversité de comportement des éléments. Le point de départ de
cette théorie fut une classification des éléments, selon leurs propriétés chimiques.
C'est en 1869 que Dimitri Ivanovitch Mendeleïev, chimiste russe (1834-1907), publia sa classification
périodique qui devint fameuse par la suite.
Dans cette classification, les éléments étaient classés par valeur croissante des masses atomiques.
Mendeleïev remarqua ainsi que les propriétés des éléments variaient périodiquement. Il classa alors les
éléments de la manière suivante:
- masse atomique croissante le long d'une colonne
- éléments de propriétés similaires sur une même ligne.
Lorsqu'un élément ne figurait pas dans la bonne case, Mendeleïev n'hésitait pas à contester la valeur de sa
masse atomique et à la modifier.
Mendeleïev laissa aussi des cases libres pour des éléments qui, pensait-il, existaient mais n'étaient pas
encore découverts. Les découvertes du Gallium, du Scandium et du Germanium donnèrent raison à Mendeleïev
et finirent de convaincre les sceptiques de la logique de construction et de l'utilité de la classification.
En 1911, Rutherford publia ses travaux sur la structure des atomes. La classification par masse atomique
fut remplacée par la classification par numéro atomique, et on s'aperçut que les deux correspondaient.
II. LA CLASSIFICATION ACTUELLE :
Elle comporte 112 éléments chimiques connus. Elle est constituée de 18 colonnes et de 7 lignes ou périodes.
On distingue deux catégories d’éléments : les métaux et les non-métaux.
Les éléments sont classés par numéro atomique Z croissant.
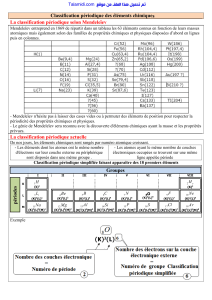
2.1. Classification périodique simplifiée des 18 premiers éléments :

2.2. Caractéristiques de cette classification :
En examinant la présentation du tableau périodique ci-dessus on peut s’apercevoir que :
Dans une même ligne, les atomes des éléments ont le même nombre de couches électroniques
occupées. Première ligne : couche K, deuxième ligne : couche L et troisième ligne : couche M.
Dans une même colonne, les atomes des éléments ont le même nombre d’électrons sur leur couche
externe.
III. LES FAMILLES CHIMIQUES :
3.1. Notion de famille chimique : TP4
Les éléments ayant des propriétés chimiques voisines forment une famille. Ils sont placés dans la même
colonne. Ces propriétés sont dues aux nombres d’électrons de la couche externe.
3.2. La famille des alcalins :
A l’exception de l’hydrogène, les éléments de la première colonne appartiennent à la famille des alcalins.
Dans la nature on les rencontre sous forme d’ions Li+ , Na+ ou K+, comme dans l’eau ou les eaux minérales. Ils
sont responsables du goût salé. A l’état de corps purs simples se sont des métaux mous qui réagissent
spontanément avec le dioxygène de l’air ou l’eau. Les éléments alcalins ne forment pas de molécules.
3.3. La famille des halogènes :
Dans la nature, on les rencontre sous forme d’ions monoatomiques : F- ; Cl- ; Br-. Ils peuvent également
exister sous forme de molécules diatomiques : F2 , Cl2 , Br2 . Ces espèces chimiques sont fortement colorées
et très nocives.
3.4. La famille des gaz nobles :
Ce sont les éléments chimiques les plus stables. Ils sont inertes chimiquement c’est-à-dire qu’ils ne
participent à aucune réaction chimique. Ils ne forment pas d’ions ni de molécules. Ils sont peu présents dans
l’atmosphère terrestre. L’hélium est l’élément le plus abondant dans l’Univers après l’hydrogène.

Activité 4 : La naissance du tableau périodique
Activités documentaire 1 et 2 Belin p 102 :
1. Au XIXe siècle, on caractérisait les éléments chimiques à partir de leur masse atomique.
2. La masse atomique du carbone est égale à 12, cela signifie que le carbone est 12 fois plus
lourd que l’hydrogène.
3. A l’époque de Mendeleïev, 63 éléments chimiques sont connus.
4. Dans une colonne, les éléments sont classés par masse atomique croissante.
5. Pour respecter la périodicité, Mendeleïev a été amené à inverser certains éléments comme
le tellure et l’iode, l’or et le mercure …
6. Périodique signifie que les éléments ayant des propriétés similaires se retrouvent à des
intervalles réguliers dans le tableau.
7. Les éléments ayant des propriétés voisines de celles de l’oxygène sont le soufre, le sélénium
et le tellure. Les éléments ayant des propriétés voisines de celles du carbone sont le
silicium, le germanium et l’étain.

La classification périodique simplifiée des 18 premiers éléments
La classification périodique simplifiée des 18 premiers éléments
1
/
5
100%