Les vecteurs amplicons dérivés du virus HSV1

revue
Les vecteurs amplicons dérivés du virus HSV1 :
un système souple et puissant pour le transfert
de gènes
J. Thomas
D. Cuchet
C. Potel
A.L. Epstein
Université Lyon 1, 69003 Lyon,
CNRS, UMR5534,
Centre de génétique moléculaire
et cellulaire,
69622 Villeurbanne
Résumé.Les amplicons sont des vecteurs défectifs et non intégratifs dérivés du
virus herpes simplex de type 1 (HSV1). Leur génome ne contient aucun gène
viral, ce qui leur confère une totale innocuité pour les cellules infectées et les
animaux inoculés. De plus, ils sont capables de véhiculer jusqu’à 150 kpb
d’ADN exogène, ce qui les classe parmi les vecteurs viraux les plus puissants et
les plus prometteurs pour le transfert de gènes. Cette revue illustre quelques-unes
des nombreuses applications utilisant les amplicons, ainsi que les questions qui
restent à résoudre pour obtenir une expression stable et physiologique du
transgène.
Mots clés :HSV1, amplicon, thérapie du cancer, thérapie génique, applications
fondamentales
Abstract.Amplicons are non-integrative defective herpes simplex type 1
(HSV1) derived vectors. Their genomes are entirely free of viral genes, making
these vectors non toxic for infected cells and non pathogenic for inoculated
animals. In addition, amplicon vectors possess the unique property of delivering
up to 150 kbp of foreign DNA. These characteristics make amplicon vectors one
of the most powerful and promising viral vectors for gene transfer. This review
illustrates several interesting applications using amplicon vectors, as well as
problems that need to be resolved in order to obtain stable and physiological
transgene expression.
Key words:HSV1, amplicon, cancer therapy, gene therapy, fundamental
applications
Au cours de ces vingt dernières années, l’amélioration des
méthodes de transfert de gènes et la compréhension des
facteurs contrôlant leur expression dans les cellules ou
organismes mammifères ont été, et restent, des objectifs
majeurs de la biologie cellulaire et moléculaire. Comme les
virus possèdent naturellement les éléments moléculaires
permettant le transfert de gènes et leur expression efficace
dans la majorité des cellules, les vecteurs viraux demeurent
les outils les plus intéressants. Cette revue est plus particu-
lièrement consacrée aux vecteurs amplicon dérivés du virus
herpes simplex de type 1 (HSV1). Ces vecteurs, qui sont
défectifs, non intégratifs et dépendants de virus auxiliaires,
s’inscrivent parmi les vecteurs viraux les plus puissants, les
plus souples et les plus prometteurs pour le transfert de
gènes.
D’un point de vue structural et immunologique, les ampli-
cons [1] sont identiques au virus HSV1 sauvage et, par
conséquent, possèdent le même large spectre d’hôtes et de
tissus. Les particules d’HSV1 sont composées d’une qua-
rantaine de protéines structurales qui sont délivrées dans les
cellules lors de l’infection. En l’absence de néosynthèse de
protéines virales, ces dernières disparaissent assez rapide-
ment après l’infection, permettant à la cellule de retrouver
ses fonctions normales. La différence majeure entre un
vecteur amplicon et le HSV1 réside dans la substitution du
génome d’HSV1, au sein de la particule virale, par un
concatémère d’ADN plasmidique, qui forme ainsi le
Tirés à part : A.L. Epstein
Virologie 2007, 11 (5) : 339-50
doi: 10.1684/vir.2007.0115
Virologie, Vol. 11, n° 5, septembre-octobre 2007
339
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

génome du vecteur amplicon. Le génome amplicon dérive
d’un plasmide, appelé plasmide amplicon. Ce dernier (fi-
gure 1) correspond à un plasmide standard d’Escherichia
coli qui contient, en plus des séquences transgéniques d’in-
térêt, une origine de réplication virale (OriS) et un signal de
clivage et d’encapsidation (a) d’HSV1. Un des avantages
pour le transfert de gènes est donc l’absence de gènes
viraux dans le génome amplicon, ce qui confère à ces
derniers une totale innocuité pour les cellules infectées et
les animaux inoculés. De plus, cette absence de gènes
viraux réduit drastiquement le risque de réactivation, com-
plémentation ou recombinaison avec des génomes latents
de HSV1 sauvages.
La flexibilité des amplicons est en partie due au fait que,
lors de leur production, leur génome se réplique, comme le
génome d’HSV1, selon un mécanisme de cercle roulant,
générant de longs concatémères composés de répétitions en
tandem du plasmide amplicon [2] (figure 2). Les particules
infectieuses d’HSV1 empaquettent toujours 150 kpb
d’ADN, ce qui correspond à la taille du génome viral. Au
niveau du génome amplicon, cela se traduit par un nombre
variable de répétitions du plasmide, en fonction de la taille
initiale de ce plasmide [3]. Par exemple, un plasmide ampli-
con de 5 kpb sera répété environ 30 fois sous la forme
génome, alors qu’un plasmide amplicon comportant un
locus génomique de 150 kpb ne sera présent qu’en une
seule copie. C’est le deuxième avantage résultant de l’ab-
sence de gènes viraux dans le plasmide amplicon, qui laisse
ainsi une place disponible pour l’insertion de très grands
fragments d’ADN, allant jusqu’à la taille maximale de
150 kpb. Cette dernière propriété apporte, sans conteste,
une spécificité particulière aux amplicons. En effet, aucun
autre système de vecteur viral n’est aujourd’hui capable de
délivrer autant d’ADN exogène dans le noyau d’une cellule
de mammifère.
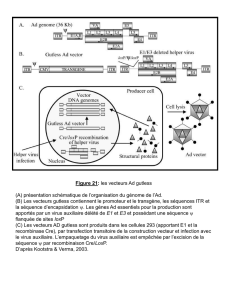
La production des amplicons implique l’intervention de
plus d’une cinquantaine de protéines virales qui sont néces-
saires à la réplication et à l’empaquetage du génome ampli-
con dans une particule virale. Le plasmide amplicon étant
dépourvu de gènes viraux, les protéines codées par ces
gènes doivent nécessairement être apportées en trans, soit
par un HSV1 auxiliaire, soit par de l’ADN viral, soit par des
cellules transcomplémentantes.Actuellement, deux métho-
des sont principalement utilisées pour la production des
amplicons. La première repose sur l’utilisation d’un virus
auxiliaire génétiquement modifié, possédant une séquence
d’encapsidation unique, entourée par deux sites loxP en
orientation parallèle. Ce virus est également défectif grâce
à la délétion du gène codant pour la protéine essentielle
ICP4. Tout d’abord, des cellules exprimant ICP4 sont trans-
fectées par un plasmide amplicon et surinfectées par le
virus auxiliaire décrit. Un premier stock viral dit intermé-
diaire se composant de vecteurs amplicons et de virus
auxiliaires est alors obtenu. Il est ensuite utilisé pour infec-
ter des cellules exprimant simultanément ICP4 et la recom-
binase CRE. Le virus auxiliaire présent dans le stock inter-
médiaire apporte l’ensemble des fonctions permettant
l’amplification et l’encapsidation du génome amplicon. En
revanche, le génome du virus auxiliaire lui-même n’est pas
encapsidé à cause de la délétion des signaux d’encapsida-
tion par la recombinase CRE. Cette technique permet d’ob-
tenir des stocks importants de vecteurs amplicons, très
faiblement contaminés par des particules du virus auxiliaire
défectif et non pathogène [4], qui peuvent donc être utilisés
dans des essais thérapeutiques chez l’animal (figure 3).La
seconde technique de production repose sur la cotransfec-
tion du plasmide amplicon avec un génome d’HSV1 cloné
dans un chromosome bactérien artificiel. Ce génome a été
modifié de manière à ne pas pouvoir être encapsidé : 1) par
la délétion des séquences d’encapsidation (a)et2)en
rajoutant des séquences qui augmentent sa taille. De plus, le
gène
␣
27 codant pour la protéine essentielle ICP27 a été
éliminé pour être rendu plus sûr [5, 6]. La cotransfection
s’effectue donc dans des cellules exprimant ICP27
(figure 4). Cette technique a permis, pour la première fois,
la production de stocks d’amplicons totalement dépourvus
de contamination par des virus recombinants. Cependant,
ce système de production, fondé sur des méthodes de trans-
fection, permet uniquement la production d’amplicons en
faible quantité, limitant ainsi leur utilisation. Donc à ce
jour, aucune méthode combinant l’absence totale de conta-
mination par des particules auxiliaires et la production de
stocks importants de vecteurs amplicon n’est disponible.
Ainsi, des travaux sur l’amélioration de la production des
amplicons sont encore nécessaires et devraient permettre de
passer outre ces limitations.
Dans cette revue, nous décrirons quelques-unes des nom-
breuses applications développées récemment avec les am-
plicons, tout en mentionnant également les limitations ac-
tuelles de l’utilisation de ces vecteurs.
Les amplicons et leurs applications
dans la thérapie du cancer
Les vecteurs amplicon ont été utilisés dans la plupart des
stratégies anticancéreuses. En effet, ils sont capables de
transférer efficacement des gènes dans la plupart des cellu-
les cancéreuses, in vitro comme in vivo. Cependant,
comme ils ne sont pas autoréplicatifs, ils se diluent durant
les divisions cellulaires. C’est pourquoi la majorité des
études ont utilisé des méthodes drastiques, comme la des-
truction rapide de la cellule cancéreuse, ou une approche
systémique basée sur l’immunothérapie ou les thérapies
anti-angiogéniques. Les principales voies anticancéreuses
ayant été ciblées par des amplicons sont résumées dans la
figure 5.
revue
Virologie, Vol. 11, n° 5, septembre-octobre 2007
340
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Thérapies anti-angiogéniques
Une stratégie antitumorale, qui semble particulièrement
prometteuse, consiste à inhiber la néovascularisation du
tissu cancéreux afin de limiter l’approvisionnement des
cellules et d’induire une hypoxie. Deux études ont pu
montrer une importante inhibition de la croissance tumo-
rale et donc une réduction du volume de tumeurs hépatiques
[7] et pancréatiques [8] après leur infection par des ampli-
cons exprimant l’inhibiteur angiogénique sFlk1, une ver-
sion dominante négative du récepteur au facteur de crois-
sance vasculaire endothélial (VEGF), par rapport aux
tumeurs non infectées. L’inhibiteur a été mis sous le
contrôle du promoteur inductible par hypoxie permettant
ainsi de tirer parti des conditions d’hypoxie, naturellement
retrouvées dans la plupart des tumeurs.
Immunothérapies
Plusieurs approches immunothérapeutiques ont été décri-
tes, dont l’utilisation d’amplicon, pour exprimer des anti-
gènes spécifiques des cellules cancéreuses. En effet, les
amplicons peuvent infecter efficacement des cellules pré-
sentatrices d’antigènes en culture, comme des cellules den-
dritiques humaines et murines, ou des cellules lymphocy-
taires B issues de leucémie chronique. Willis et al. [9] ont
infecté des cellules dendritiques de souris in vitro avec un
amplicon exprimant un antigène spécifiquement présent
sur des cellules de carcinomes de la prostate. Après réintro-
duction de ces cellules dans la souris, ils ont pu mettre en
évidence une réponse cytotoxique médiée par les lympho-
cytes T, réponse qui est dirigée spécifiquement contre les
cellules exprimant cet antigène. De plus, les souris ainsi
immunisées sont protégées contre de nouvelles tumeurs
exprimant ce même antigène.
Une deuxième approche vise à utiliser les amplicons pour
induire la sécrétion de cytokines par les cellules cancéreu-
ses afin de stimuler la réponse immunitaire antitumorale.
Par exemple, un amplicon exprimant le facteur de crois-
sance GM-CSF (granulocyte-macrophage colony-
stimulating factor), injecté in situ au niveau d’un méla-
nome chez la souris, inhibe la croissance tumorale. De
manière intéressante, cette expérience a également démon-
tré la mise en place d’une immunité antitumorale systémi-
que qui entraîne l’inhibition de la croissance d’une tumeur
collatérale non infectée [10].
Une troisième stratégie utilise les amplicons pour modifier
ex vivo la capacité des cellules tumorales à exprimer des
molécules d’adhésion ou des protéines costimulatrices,
avant de les réintroduire dans l’hôte. Par exemple, dans un
modèle de métastases hépatiques, une réponse immune
médiée par les lymphocytes a été observée après injection
de cellules tumorales préalablement infectées par des am-
plicons exprimant RANTES, B7.1 et/ou le facteur de crois-
sance GM-CSF. De plus, des cellules lymphocytaires B
issues de leucémie chronique, qui ont été infectées par des
Séquences
bactériennes
Séquences
transgéniques
a
OriS
Figure 1. Structure du plasmide amplicon. Un plasmide amplicon
est un plasmide d’Escherichia coli standard (contenant une origine
de réplication bactérienne et un gène de résistance à un antibio-
tique) portant une origine de réplication (OriS) et un signal de
clivage/encapsidation (séquence a) herpétiques, ainsi qu’une sé-
quence transgénique d’intérêt (représentée par la flèche rouge).
Concatémère de plasmides amplicon
Taille totale ~ 150 kpb
Particule
virale HSV1
aOriS aOriS OriS
a
Figure 2. Structure du vecteur amplicon. Un vecteur amplicon se compose d’une particule virale d’HSV1 contenant un concatémère de
150 kpb composé d’unités dérivées du plasmidique amplicon.
revue
Virologie, Vol. 11, n° 5, septembre-octobre 2007
341
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

amplicons exprimant B7.1 et/ou CD40L ou LIGHT, provo-
quent une augmentation de la présentation d’antigènes et
l’induction d’une forte réponse proliférative des cellules T
[11, 12]. Enfin, un vaccin contre la leucémie a été généré en
utilisant des lignées cellulaires lymphoblastiques infectées
par des amplicons exprimant IL2 et CD70. Le traitement de
souris avec ces cellules a permis de diminuer de manière
significative la prolifération des cellules lymphoblastiques
et d’augmenter ainsi la survie de ces animaux [13].
Enfin, les propriétés immunostimulatrices décrites précé-
demment pourraient également être utilisées en association
avec d’autres traitements, comme c’est déjà le cas en com-
binaison avec des stratégies oncolytiques utilisant des vec-
teurs HSV1 recombinants [14, 15].
Expression de gènes antitumoraux
La plupart des mises au point pour l’amélioration de l’effi-
cacité et l’innocuité des thérapies contre le cancer par
ciblage des cellules prolifératives ont été réalisées en utili-
sant des gliomes. L’infection de cellules humaines dérivées
de glioblastome par des amplicons exprimant la protéine
très précoce ICP0 d’HSV1 [16], qui possède une activité
E3-ubiquitine ligase et induit notamment la dégradation de
protéines centromériques, entraîne un arrêt de la proliféra-
tion de ces cellules ainsi que leur mort par nécrose. En
revanche, l’infection par ce même amplicon de cellules qui
Virus
auxiliaires
Virus HSV1
auxiliaires défectifs
0,5 %
Virus HSV1
auxiliaires
défectifs
Plasmide
amplicon
Surinfection
T ransfection
Vecteurs
amplicon
Infection
CRE
ICP4
Vecteurs
amplicon
ICP4
Figure 3. Méthode de production des vecteurs amplicon à l’aide
de virus HSV1 auxiliaires défectifs. Des cellules transcomplémen-
tantes, pour une fonction virale essentielle, sont transfectées par le
plasmide amplicon et surinfectées par un HSV1 auxiliaire défectif.
À cette étape, le ratio entre les vecteurs amplicon et les virus
auxiliaires obtenus est d’environ 1:1. Des cellules exprimant la
recombinase Cre sont ensuite infectées par le stock viral précé-
demment obtenu. La recombinase CRE induit la délétion de la
séquence de clivage/encapsidation (a), entourée de deux sites
loxP, du génome des virus auxiliaires, empêchant alors leur
encapsidation. Cela résulte en une production de stocks de
vecteurs amplicon faiblement contaminés par des virus auxiliaires
défectifs (0,1 à 1 %).
Séquences
bactériennes
BAC-HSV1
Cotransfection
Vecteurs
amplicon
ICP27
Plasmide
amplicon
Génome HSV1
augmenté en taille
amputé des séquences
Na0 et α27
Figure 4. Méthode de production des vecteurs amplicon par
cotransfection avec le génome HSV1. Un BAC portant le génome
HSV1 amputé de la séquence aet du gène
␣
27, codant pour la
protéine ICP27, et le plasmide amplicon sont cotransfectés dans
des cellules exprimant ICP27. Comme la taille du génome d’HSV1
porté par le BAC a été augmentée et que ses séquences d’encap-
sidation ont été éliminées, celui-ci ne peut pas être incorporé dans
les particules d’HSV1. Cela permet d’obtenir des stocks de vec-
teurs amplicon purs.
revue
Virologie, Vol. 11, n° 5, septembre-octobre 2007
342
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

ne se divisent pas, comme des cardiomyocytes ou des
neurones de rat, n’entraîne aucune mortalité ou toxicité
induite par ICP0. Ces résultats démontrent ainsi le potentiel
thérapeutique possible de la protéine virale ICP0 [17].
Une autre stratégie développée est le ciblage des cellules
tumorales par le contrôle transcriptionnel de transgènes
d’intérêt thérapeutique. Par exemple, Ho et al. [18] ont dans
un premier temps construit un amplicon, dans le génome
duquel le transgène est sous le contrôle d’un promoteur
chimère comportant les éléments enhancers et promoteurs
de la GFAP (glial fibrillary acidic protein) ainsi que les
éléments régulateurs spécifiques du cycle cellulaire du pro-
moteur de la cycline A. Le vecteur amplicon résultant est
capable d’exprimer le transgène de manière dépendante du
cycle cellulaire et spécifiquement dans les cellules issues de
gliome in vitro et in vivo. Ce même promoteur chimère a été
utilisé avec succès in vitro et in vivo pour tester l’efficacité
antitumorale de protéines proapoptotiques comme le ligand
FasetFADD(Fas-associated protein with a death do-
main) délivrés par l’amplicon [19]. Deux autres protéines
proapoptotiques, TRAIL (tumor necrosis factor-related
apoptosis inducing ligand) et sa version sécrétée S-TRAIL,
ont été testées dans les cellules Gli36 et dans des gliomes
[20, 21]. Les résultats obtenus après infection ont montré
l’induction d’une apoptose in vitro et une réduction des
gliomes in vivo. L’ensemble de ces résultats permet de
démontrer le potentiel de l’utilisation des amplicons pour
délivrer des gènes proapoptotiques. Enfin, une étude plus
récente a utilisé les amplicons pour exprimer des petits
ARN interférents (siRNA) afin d’inhiber post-
transcriptionnellement le gène EGFR (epidermal growth
factor receptor). L’inhibition de ce gène dans des cellules
issues de glioblastome humain provoque une diminution de
leur croissance in vitro et in vivo [22].
Stratégie d’activation de prodrogues
Parmi le grand nombre d’enzymes transformant des molé-
cules en drogue antitumorale testées en thérapie anticancé-
reuse, certaines ont été exprimées via un vecteur amplicon.
Par exemple, l’expression à partir d’un amplicon de la
thymidine kinase (TK), qui permet de convertir le ganciclo-
vir en un analogue toxique, induit la mort des cellules
infectées [23]. Par ailleurs, Rainov et al. [24] ont construit
un amplicon exprimant la protéine de fusion 4B1:EGFP qui
a été utilisé pour traiter des gliomes humains et murins.
Cette protéine chimérique combine les avantages de l’ex-
pression du cytochrome P450B41, un puissant gène suicide
bioactivateur, avec celle de la protéine EGFP. L’introduc-
tion de l’amplicon exprimant la protéine 4B1:EGFP trans-
forme la cyclophosphamide (CPA) en métabolites toxiques.
Par imagerie, il a été possible d’observer un puissant effet
collatéral médié par la transmission de ces métabolites de
cellule en cellule.
Les amplicons en thérapie génique
du système nerveux
La plupart des travaux en thérapie génique se sont focalisés
sur la protection contre les dommages du cerveau. Seules
quelques études utilisant des amplicons ont été réalisées sur
le traitement thérapeutique de désordres neurodégénératifs,
comme la maladie de Parkinson, ou des maladies généti-
ques, comme les ataxies (figure 6).
Neuroprotection
Une mort cellulaire est observée dans de nombreuses pa-
thologies ou chirurgies du cerveau. De ce fait, plusieurs
approches ont été développées pour réduire la neurotoxicité
Inhibition de la vascularisation
des tumeurs
Augmentation de l’immunité
antitumorale
Induction de la mort
des cellules cancéreuses
Métabolisation de
prodrogues
Figure 5. Principales voies anticancéreuses ayant été ciblées par les vecteurs amplicons.
revue
Virologie, Vol. 11, n° 5, septembre-octobre 2007
343
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%