Corrigé - BrinDeNuage

BAC 2013 – Métropole Série S – Physique obligatoire
EXERCICE I - UN CATALYSEUR ENZYMATIQUE, L’URÉASE (5 points)
1. Activité enzymatique de l’uréase
1.1. L’uréase, un catalyseur
1.1.1. NH2 – CO – NH2 + H2O = 2NH3 + COZ
1.1.2. Le temps de demi-réaction (par rapport à un réactif donné A) est le temps nécessaire pour que
la concentration de ce réactif ait diminué de moitié.
1.1.3. Un catalyseur est une molécule qui, en petite quantité, accélère la vitesse d'une réaction et qui
revient à sa forme initiale à la fin de la réaction.
Initialement, le temps de demi-réaction de l’urée avec l’eau est de 60 ans alors que, toutes
conditions étant égales par ailleurs, en présence d’uréase, celui-ci est de 2x10-5s. L’uréase a
donc bien augmenter la vitesse de réaction et est par conséquent un catalyseur.
1.2. Effet de la température sur l’activité enzymatique
1.2.1. La température va augmenter l’agitation des molécules dans une solution. Les composés vont
donc se rencontrer plus fréquemment ce qui en général va avoir tendance à augmenter la
vitesse de réaction.
1.2.2. Le document 1 montre que dans un premier temps avec l’augmentation de la température,
l’activité de l’uréase et donc la vitesse de réaction va augmenter, la cinétique de la réaction
étant directement liée à l’activité de l’uréase. Cependant à partir de 60°C, l’activité de l’uréase
va baisser ce qui va conduire à une diminution de la vitesse de réaction.
1.2.3. Dans le texte introductif il est mentionné que les liaisons hydrogènes qui conduisent à la
formation de la structure tridimensionnelle de l’enzyme se forment plus ou moins facilement
selon la température. On peut donc en déduire que l’augmentation de la température va dans
un premier temps faciliter la formation de ces liaisons hydrogènes mais que au-delà d’un
certain seuil la température va avoir tendance à altérer la formation des liaisons hydrogènes ce
qui va déformer la molécule qui ne pourra plus remplir correctement son rôle de catalyseur.
2. L’uréase dans le milieu stomacal
2.1 L’acide chlorhydrique est un acide fort donc HCl + H2O=> H3O+ + Cl- et [HCl]=[H3O+]=1,0×10-2mol.L-1
D’où pH=-log([H3O+])=-log([HCl])=-log(1,0x10-2)=2
2.2 pKa(NH4
+/NH3)=9,2 or on sait que pH=2
On a donc que pH<pKa, c’est donc la forme acide du couple acide base qui va prédominer
c'est-à-dire NH4
+
2.3 La bactérie en fabriquant de l’ammoniac dans son environnement proche va produire la réaction
chimique : NH3 + H3O+ NH4+ + H2O.
Cela va donc consommer les ions H3O+ responsable de l’acidité. Ainsi dans son environnement proche
la bactérie va augmenter le pH et rendre le milieu plus basique.

2.4 Le document 2 montre que dans un milieu acide à une température de 30°C, l’activité de l’uréase
est nulle. La molécule ne peut donc pas remplir son rôle de catalyseur et dans ces conditions, la
formation de l’ammoniac de pourra avoir lieu. L’estomac est un environnement acide (pH=2) où la
température avoisine les 37°C. Il est donc impossible dans ces conditions que l’uréase remplisse son
rôle seul dans l’estomac. La bactérie se doit donc de sécréter d’autres entités chimiques pour
favoriser l’action de l’uréase.
EXERCICE II – PRINCIPE DE FONCTIONNEMENT D’UN GPS (10 points)
1. A propos de la localisation
Il se situe à Bourges.
Les deux cercles se croisent en deux points. Le point le plus à l’Est n’est pas en France, le point
restant est donc Bourges.
2. Etude du mouvement d’un satellite
2.1. Seconde loi de Newton :
Dans notre cas :
On a donc et qui ont la même direction et le
même sens.
Dans le repère de Frenet, on a :
Or, on a montré que et
ont même sens et direction donc
v est constante donc le mouvement est uniforme

2.2.
AN :
2.3.
On a :
AN :
3. Précision des mesures
3.1.
Précision voulue : 10 m dans le sens de propagation de la lumière
On étudie l’effet sur la distance d’une erreur de
On considère que le signal se propage toujours à une vitesse c.
Pour garantir une précision de 10 m, il faut donc une précision de 30ns sur la mesure de la
durée du signal du GPS.
3.2. On a :
On considère que la distance à parcourir est la moyenne de l’altitude des satellites et que le
signal se propage toujours à une vitesse c.
Précision relative
3.3. L’énoncé indique un décalage de 38µs par jour (24h) si on ne tient pas compte des effets
relativistes.
Pour un décalage de 30ns :
4. Etude du signal GPS
4.1. 1 octet = 8 bits

La taille du signal est de
Le débit est de 50bit/s
On a donc
Le GPS garde en mémoire les informations reçues désignant sa position avant son arrêt, il
peut ainsi indiquer à l’utilisateur sa position avant le téléchargement complet du signal.
4.2.
EXERCICE III - SAVEUR SUCRÉE (5 points)
1. Analyse et synthèse de documents
Dans les documents il est présenté trois types d’espèce sucrantes : les oses (ou sucres), les polyols et
les édulcorants. Ces trois types d’espèce possèdent des caractéristiques bien particulières et seront
donc utilisés pour différents usages dans l’alimentation.
Tout d’abord il existe une différence dans la composition des composés, les oses contiennent par
exemple un groupe carbonyle ainsi que plusieurs groupes hydroxyles. De leur côté les polyols ne
contiennent que des groupes hydroxyles. Enfin les édulcorants sont des produits de synthèse à la
formule complexe.
Concernant le pouvoir sucrant il existe une réelle différence entre les oses et les polyols dont le
pouvoir sucrant se situe autour de 1 et celui les édulcorants qui atteint 200. Une différence est aussi
notable dans l’apport énergétique qui est généralement autour de 15 kJ.g-1 pour les oses et les
polyols et quasiment 0 pour les édulcorants. Cela justifie donc l’emploi de l’aspartame dans les
boissons dites « light » qui va fournir un pouvoir sucrant équivalent pour moins de composé utilisé et
de calories.
Enfin l’effet sur la santé est peut-être le plus important dans cette étude car le plus sensible pour les
consommateurs. Même si le sucre est responsable des caries à l’inverse des polyols et des
édulcorants il a un effet libérateur d’insuline qui joue un rôle important dans la régulation du sucre
dans le sang or les polyols n’ont qu’un effet limité. De plus dans l’absence de certitudes sur l’impact
sur la santé il est nécessaire de réguler la consommation de ces substances jusqu’à y voir plus clair.

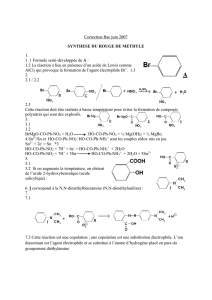
2. La synthèse de l’aspartame
2.1 a=acide carboxylique
b=amine
c=acide carboxylique
d=amide
2.2 HOOC-CH2-CH(NH2)-COOH l'atome de carbone asymétrique est représenté en gras
La représentation de Cram des énantiomères : figures symétriques selon un axe vertical
2.3 La synthèse de l'aspartame nécessite que le groupe (c) COOH réagisse avec la fonction amine
de l'ester méthylique : HOOC-CH2-CH(NH2)-COOH + NH2-CH(COOCH3)-CH2-C6H5
Or, sans protection du groupe caractéristique (a), il pourrait aussi réagir avec la fonction
amine de l'ester : HOOC-CH2-CH(NH2)-COOH + NH2-CH(COOCH3)-CH2-C6H5
Sans la protection du groupe (b), c'est le groupe amine de l'acide aspartique qui pourrait
réagir avec les groupes caractéristiques carboxylique de l'acide aspartique : HOOC-CH2-
CH(NH2)-COOH + HOOC-CH2-CH(NH2)-COOH ou HOOC-CH2-CH(NH2)-COOH + HOOC-CH2-
CH(NH2)-COOH
Il est donc nécessaire de protéger ces groupes caractéristiques afin d'éliminer toute réaction
parasite.
1
/
5
100%