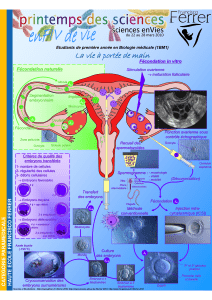
Évaluation d`un incubateur «Time-Lapse

R
RA
AP
PP
PO
OR
RT
T
D
D’
’É
ÉV
VA
AL
LU
UA
AT
TI
IO
ON
N
S
SU
UR
R
L
L’
’E
EN
NV
VI
IR
RO
ON
NN
NE
EM
ME
EN
NT
T
G
GU
UÉ
ÉR
RI
IS
SS
SA
AN
NT
T
E
EN
N
O
ON
NC
CO
O-
-P
PÉ
ÉD
DI
IA
AT
TR
RI
IE
E
R
RA
AP
PP
PO
OR
RT
T
D
D’
’É
ÉV
VA
AL
LU
UA
AT
TI
IO
ON
N
S
SU
UR
R
L
L’
’E
EN
NV
VI
IR
RO
ON
NN
NE
EM
ME
EN
NT
T
G
GU
UÉ
ÉR
RI
IS
SS
SA
AN
NT
T
E
EN
N
O
ON
NC
CO
O-
-P
PÉ
ÉD
DI
IA
AT
TR
RI
IE
E
ÉVALUATION D’UN INCUBATEUR MUNI DE
LA TECHNOLOGIE « TIME-LAPSE » DANS
LE CADRE DE L’IMPLANTATION DE LA
CLINIQUE DE PROCRÉATION
MÉDICALEMENT ASSISTÉE DU CHUS
UETMIS
UNITÉ D’ÉVALUATION DES
TECHNOLOGIES ET DES MODES
D’INTERVENTION EN SANTÉ
© UETMIS 2013

Unité d’évaluation des technologies et
des modes d’intervention en santé
É
ÉV
VA
AL
LU
UA
AT
TI
IO
ON
N
D
D’
’U
UN
N
I
IN
NC
CU
UB
BA
AT
TE
EU
UR
R
M
MU
UN
NI
I
D
DE
E
L
LA
A
T
TE
EC
CH
HN
NO
OL
LO
OG
GI
IE
E
«
«
T
TI
IM
ME
E-
-L
LA
AP
PS
SE
E
»
»
D
DA
AN
NS
S
L
LE
E
C
CA
AD
DR
RE
E
D
DE
E
L
L’
’I
IM
MP
PL
LA
AN
NT
TA
AT
TI
IO
ON
N
D
DE
E
L
LA
A
C
CL
LI
IN
NI
IQ
QU
UE
E
D
DE
E
P
PR
RO
OC
CR
RÉ
ÉA
AT
TI
IO
ON
N
M
MÉ
ÉD
DI
IC
CA
AL
LE
EM
ME
EN
NT
T
A
AS
SS
SI
IS
ST
TÉ
ÉE
E
D
DU
U
C
CH
HU
US
S
Juin 2013
© UETMIS-CHUS, 2013


Page i
LA MISSION
L’Unité d’évaluation des technologies et des modes d’intervention en santé (UETMIS) du Centre
hospitalier universitaire de Sherbrooke (CHUS) est un regroupement d’experts dont les avis sont
susceptibles d’influencer les décisions prises par l’administration hospitalière concernant les
investissements en technologie de la santé, l’implantation des technologies émergentes et les
changements dans la pratique des soins et les modes d’intervention en santé (distribution des soins et
organisation des services). Le créneau privilégié par l’UETMIS est « l’évaluation des pratiques et des
modes d’intervention en santé ». Les évaluations tiennent compte de plusieurs volets, dont l’efficacité, la
sécurité et l’efficience des technologies, ainsi que les impacts éthiques, organisationnels et économiques
liés à l’implantation et à l’administration des dites technologies. L’approche globale de l’UETMIS est de
développer l’évaluation des technologies en respectant les priorités établies dans la planification
stratégique et les projets conjoints avec le Centre de recherche clinique Étienne-Le Bel du CHUS.
UNITÉ D’ÉVALUATION DES TECHNOLOGIES ET DES MODES
D’INTERVENTION EN SANTÉ DU CHUS
Christian Bellemare, M. Sc.
Coordonnateur
Jean-François Fisette, Ph. D.
Conseiller en évaluation des technologies
Suzanne K. Bédard, T. M., B. A.
Conseillère en évaluation des technologies
Thomas Poder, Ph. D.
Conseiller-cadre en évaluation des technologies
Monique Robillard
Agente administrative C1

Page ii
Dépôt légal
Bibliothèque nationale du Québec
Bibliothèque nationale du Canada
ISBN 978-2-9812570-6-2
© UETMIS-CHUS, 2013
Pour tout renseignement sur ce document ou sur les activités de l’UETMIS du CHUS, s’adresser à :
Unité d’évaluation des technologies et des modes d’intervention en santé
CHUS - Hôtel-Dieu
580, rue Bowen Sud
Sherbrooke (Québec) J1G 2E8
Téléphone : (819) 346-1110, poste 11879
Pour citer ce document :
Unité d’évaluation des technologies et des modes d’intervention en santé du Centre hospitalier universitaire de Sherbrooke
(UETMIS-CHUS). Évaluation d’un incubateur muni de la technologie « Time-Lapse » dans le cadre de l’implantation de la
clinique de procréation médicalement assistée du CHUS – Rapport d’évaluation préparé par Jean-François Fisette (UETMIS
juin-2013) Sherbrooke " 2013 ", XIII, 31 p.
La reproduction totale ou partielle de ce document est autorisée, à condition que la source soit mentionnée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
1
/
49
100%