approches fonctionnelles in vivo et in vitro

6
Année 2015-2016 - Demande d’allocation doctorale
ED Santé, Sciences Biologiques et Chimie du Vivant (SSBCV) n°549
1. Informations administratives :
Nom de l’encadrant responsable de la thèse : Rozenn DALBIES-TRAN
Unité : UMR PRC 7247 - INRA Centre Val de Loire
Equipe (si unité multi-équipes):Biologie INtéGrative de l’Ovaire (BINGO)
Email de l’encadrant : dalbies@tours.inra.fr
2. Titre de la thèse : Rôle du gène BCAR4 pendant le développement embryonnaire :
approches fonctionnelles in vivo et in vitro dans des espèces d’intérêt agronomique
3. Résumé :
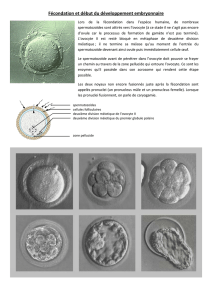
La qualité de l’ovocyte repose sur trois piliers: i) la maturité nucléaire, l’ovocyte devant
atteindre le stade métaphase II ; ii) la maturité cytoplasmique, avec la distribution
intracellulaire adéquate des organites; iii) et la maturité moléculaire, soit la constitution d’un
stock optimal d’ARN et protéines. En effet, l’activité de transcription est minimale
pendant la reprise de la méiose, la fécondation et les premières divisions de l’embryon :
leur bon déroulement repose donc sur le recrutement de ces facteurs ovocytaires selon
une chronologie précise, jusqu'à l’activation majeure du génome embryonnaire à un stade
variable selon les espèces : 2 cellules chez la souris, 4/8 cellules chez l’homme, 8/16 cellules
chez le lapin ou la vache.
Certains facteurs ovocytaires s’avèrent indispensables spécifiquement pour le
développement de l’embryon, définissant les gènes à effet maternel. Dans une banque
d’ADNc ovocytaires bovins, nous avons retrouvé plusieurs gènes à effet maternel déjà connus
chez la souris (Pennetier et al, 2005). De façon plus originale, nous avons découvert des
gènes sans homologues murins, parmi lesquels BCAR4 (Breast Cancer Anti-estrogen
Resistance 4) (Thélie et al, 2007). BCAR4 est conservé chez l'homme et plusieurs
mammifères domestiques dont le lapin. Chez le bovin, la protéine est synthétisée dans
l’ovocyte juste avant l’ovulation, devient abondante après la fécondation et persiste jusqu'au
stade morula. Elle est localisée à l'intérieur ou à proximité des noyaux et aux jonctions
intercellulaires. Son inhibition par microinjection d’ARN interférents dans l’ovocyte avant la
fécondation in vitro diminue le taux de développement embryonnaire (Angulo, et al, 2013).
Le gène BCAR4 a été identifié en parallèle comme un marqueur de certaines tumeurs du
sein résistantes au traitement par le Tamoxifen (Meijer et al, 2006). Selon cette équipe, la
protéine BCAR4 induit en l’absence d’estrogènes la prolifération de cellules qui en sont
habituellement dépendantes, via l’activation des récepteurs ERBB2 et ERBB3 (Godinho et al,
2010 ; van Agthoven et al, 2015). Alternativement, BCAR4 agirait en tant qu’ARN non
codant, avec des conséquences sur le contrôle épigénétique et la migration cellulaire
responsable de métastases (Xing et al, 2014; Xing et al, 2015).
Globalement, la phylogénie, le profil spatio-temporel d'expression, les données
fonctionnelles in vitro et les propriétés pro-prolifératives dans les cellules tumorales indiquent
que BCAR4 est un gène à effet maternel, impliqué dans les premières divisions de
l’embryon chez les mammifères à activation embryonnaire tardive. Pour autant, le

7
contrôle de son expression, ses mécanismes d’action et son rôle in vivo restent inconnus, et
feront l’objet de cette thèse. Les travaux seront menés selon trois axes indépendants.
• Axe 1 : rôle du gène BCAR4 in vivo. Des lapines génétiquement modifiées (porteuses d'un
gène BCAR4 inactivé) seront phénotypées sur plusieurs paramètres liés à la reproduction :
activité ovarienne, ovulation, fécondation et développement précoce, gestation, taille de
portée. Il est attendu une stérilité des femelles par arrêt prématuré du développement
embryonnaire.
• Axe 2 : mécanismes moléculaires d’action de BCAR4. Plusieurs directions seront
explorées.
2.1. l’activation des voies de signalisation de ERBB2 et ERBB3 dans l’ovocyte et l’embryon.
2.2. l’identification de protéines partenaires de la protéine BCAR4, par des approches ciblée
(co-localisation avec E-cadherine, β-caténine etc… aussi impliquées dans le développement
précoce) et «sans a priori» (co-immunoprécipitation et identification par spectrométrie de
masse).
2.3. le rôle de l’ARN non codant : co-précipitation avec l’ARN BCAR4 bovin, et
identification des partenaires (immunodétection de SNIP1 et PNUTS comme dans les cellules
tumorales humaines, ou identification de nouveaux partenaires par spectrométrie de masse).
• Axe 3 : contrôle post-transcriptionnel de l’expression et de la localisation
intracellulaire de BCAR4. La région 3’ non traduite des ARN contrôle la chronologie de
leur traduction dans l’ovocyte puis l’embryon. Elle peut aussi diriger la localisation
intracellulaire d’une protéine (Berkovits & Mayr, 2015). Nous analyserons la contribution
respective de chacun des deux transcrits BCAR4 bovins, issus de l’utilisation alternative de
deux signaux de polyadénylation dans la région 3’ non traduite.
A l’heure actuelle, notre équipe est la seule à étudier ce gène dans le contexte de la
reproduction. A travers la caractérisation du gène BCAR4, la thèse abordera des questions
scientifiques naissantes voire inédites. Elle rejoint des préoccupations médicales, des
mutations dans le gène BCAR4 pouvant être à l’origine d’infertilités féminines jusqu’alors
inexpliquées.
Références :
• An
g
ulo, et al, 2013. Hum Re
p
rod. 28:430-41.
• Berkovits & Mayr, 2015 Nature 522:363-7.
• Godinho et al, 2010. Br J Cancer. 103:1284-91.
• Meijer et al, 2006. Mol Cancer Res. 4:379-86.
• Pennetier et al, 2005. Biol Reprod. 73:713-20.
•
T
hélie et al, 2007. BMC Dev Biol. 7:125.
• van Agthoven et al, 2015. PLoS One.
10:e0136845.
• Xing et al, 2014. Cell. 159:1110-25.
• Xing et al, 2015. RNA Biol12:681-9.
4. Résumé en anglais:
Role of BCAR4 in embryo development: functional approaches in vivo and in vitro in
agronomically important species
Oocyte quality relies on three criteria: i) nuclear maturation to metaphase II; ii)
cytoplasmic maturation with an adequate localisation of organelles; and iii) molecular
maturity, through storage of an optimal pool of RNA and proteins. Indeed, transcription is
minimal throughout meiosis resumption, fertilization and the first embryonic divisions. These
stages rely mainly on recruitment of oocyte factors, up until the embryo activates its own
genome in a major way. This occurs at a species-specific stage: 2-cell in mouse, 4/8-cell in
human, 8/16-cell in rabbit or cow.
Some oocyte factors are essential precisely for embryonic development: the corresponding
genes are called maternal-effect genes. In a bovine oocyte cDNA library, we have identified
several maternal-effect genes previously known in the mouse (Pennetier et al, 2005). More
originally, we have discovered genes that do not have a murine homolog, including BCAR4
(Breast Cancer Anti-estrogen Resistance 4) (Thélie et al, 2007). BCAR4 is conserved in
human several domestic mammals including rabbit. In bovine, the BCAR4 protein is
synthesized in the oocyte just before ovulation; it becomes abundant after fertilization and
persists up until the morula stage. Microinjecting specific interfering RNA into the oocyte
before in vitro fertilization alters protein translation and results in a lower rate of embryos
developing to the morula and blastocyst stages (Angulo, et al, 2013).

8
In parallel, BCAR4 has been identified as a marker of some Tamoxifen-resistant breast
tumors (Meijer et al, 2006). According to this group, the BCAR4 protein is able to drive
proliferation of estrogen-dependant cells even in the absence of estrogens, by activating the
ERBB2 and ERBB3 receptors (Godinho et al, 2010 ; van Agthoven et al, 2015).
Alternatively, BCAR4 might act as a long noncoding RNA, with consequences onto
epigenetic control and cellular migration causing metastases (Xing et al, 2014; Xing et al,
2015).
Overall, phylogeny, expression profile, in vitro functional data and pro-proliferative effect
in tumor cells indicate that BCAR4 is a maternal-effect gene involved in the firts
embryonic divisions in mammalian species with late embryonic genome activation.
Nevertheless, its role in vivo, the control of its expression and intracellular localization, and
the underlying molecular mechanisms remain unknown. These questions will be addressed in
this PhD thesis through three independant workpackages.
1. role of BCAR4 in vivo. Genetically modified rabbit (carrying an inactivated BCAR4 gene)
will be phenotyped on several reproductive parameters: ovarian activity, ovulation,
fertilization and early embryo development, gestation, litter size... Females are expected to be
sterile due to a premature arrest of embryo development.
2. molecular mechanisms underlying BCAR4 action in the oocyte/embryo.
2.1. investigating the ERBB2 and ERBB3 signalling pathway in the oocyte/embryo.
2.2. identifying BCAR4 protein partners using both targeted approaches (co-localization with
E-cadherin, β-catenin or other candidate proteins involved in preimplantation development)
and open approaches to uncover novel partners (co-immunoprecipitation and identification by
mass spectrometry).
2.3. role of the long noncoding RNA : pull-down with BCAR4 RNA, and identifying partners
(immunodetection of candidate SNIP1 and PNUTS, as in human tumor cells; alternatively,
novel partners may be discovered by mass spectrometry).
3. post-transcriptionnal control of BCAR4 expression and intracellular localisation. The
3' untranslated region controls RNA stability and timing of translation in the oocyte and
embryo. It can also direct the corresponding protein intracellular localization (Berkovits &
Mayr, 2015). We will analyze the respective contribution in the oocyte/embryo of the two
bovine BCAR4 transcripts, resulting from alternative polyadenylation signals.
To the best of our knowledge, only our group studies the role of BCAR4 in reproduction.
Through characterizing BCAR4, this PhD thesis deals with emerging or novel scientific
questions. It also meets the medical field, as mutations in BCAR4 may be involved in a subset
of so far unexplained cases of female infertility.
References :
• An
g
ulo, et al, 2013. Hum Re
p
rod. 28:430-41.
• Berkovits & Mayr, 2015 Nature 522:363-7.
• Godinho et al, 2010. Br J Cancer. 103:1284-91.
• Meijer et al, 2006. Mol Cancer Res. 4:379-86.
• Pennetier et al, 2005. Biol Reprod. 73:713-20.
•
T
hélie et al, 2007. BMC Dev Biol. 7:125.
• van Agthoven et al, 2015. PLoS One.
10:e0136845.
• Xing et al, 2014. Cell. 159:1110-25.
• Xing et al, 2015. RNA Biol12:681-9.
5. Thèses encadrées au cours des 4 dernières années (par l’encadrant et l’éventuel co-
encadrant) :
Nom du doctorant : Leslie ANGULO
Encadrant responsable de la thèse : Rozenn DALBIES-TRAN
Dates : 2009-2012
Financement de la thèse : CIFRE
Publications de l’étudiant en 1er auteur : 2
Devenir de l’étudiant: Malgré deux publications en premier auteur, Leslie Angulo n’a
pas soutenu sa thèse. Elle possédait clairement des qualités didactiques et pour le travail de
laboratoire. Elle avait commencé à travailler à son manuscrit, mais elle n’a pas pu/su
surmonter des problèmes médicaux et personnels pour en reprendre la rédaction malgré les
relances et encouragements pendant plus de deux ans. Dernièrement, elle envisageait une
carrière dans l’enseignement secondaire ou comme attachée de recherche clinique.

9
6. Thèses en cours (par l’encadrant et l’éventuel co-encadrant) :
Aucune
7. Cinq publications principales ou brevets de l’encadrant (et de l’éventuel co-
encadrant) au cours des 4 dernières années :
• Angulo, L., Guyader-Joly, C., Auclair, S., Hennequet-Antier, C., Papillier, P., Boussaha,
M., Fritz, S., Hugot, K., Moreews, F., Ponsart, C.,Humblot, P., & Dalbies-Tran, R. (in press)
Reproduction, Fertility and Development. An integrated approach to bovine oocyte
quality: from phenotype to genes.
• Franciosi, F., Goudet, G., Tessaro, I., Papillier, P., Dalbies-Tran, R., Reigner, F., Deleuze,
S., Douet, C., Miclea, I., Lodde, V., & Luciano, A.M. (in press) Reproduction, Fertility and
Development. IVM affects chromosome segregation, spindle morphology and H4K16
acetylation in horse oocytes
• D. Monniaux, R. Dalbies-Tran, S. Fabre, N. Gérard, P. Monget, F. Clément (2014)
in La Reproduction Animale et Humaine, ed Quae, pp41. chapitre 2 : « Le développement
folliculaire ovarien et l’ovulation »
• Angulo, L., Perreau, C., Lakhdari, N., Uzbekov R., Papillier, P., Freret, S., Cadoret, V.,
Royere, D., Ponsart, C., Uzbekova, S. & Dalbies-Tran, R. (2013) Human Reprod. 28:430-441.
Breast-cancer anti estrogen resistance 4 (BCAR4) encodes a novel maternal-effect protein
in bovine and is expressed in the oocyte of human and other non-rodent mammals.
• Thelie, A., Pascal, G., Angulo, L., Perreau, C., Papillier, P., & Dalbies-Tran, R. (2012)
Molecular Reproduction and Development 79:380-391. An oocyte-preferential histone
mRNA stem loop binding protein like is expressed in several mammalian species.
8. Principaux contrats de recherche obtenus par l’encadrant (et l’éventuel co-encadrant)
au cours des 4 dernières années :
• programme PROLIFIC (2013-2017) ; financement Union Européene
• programme KOALA (2012-2014) ; financement INRA ; coordinateur
• programme REPROSEQ (2012-2014) ; financement privé Apis-gene
• programme ANR OVOGENAE2 (2008-2012) ; coordinateur
demandes en cours d'évaluation:
• projet Agence de Biomédecine (2016-2019) ; coordinateur
• projet Région Centre (2017-2019)
9. Autres thèses en cours au sein de l’équipe :
N
ombre d’HDR
dans l’équipe 5
Détail des
étudiants en thèse
dans l’équipe
(Nom des
encadrants et
calendrier de ces
thèses)
Nom étudiant Dates : début
et fin de thèse
Nom de l’encadrant (en gras) et
éventuel co-encadrant (entre
parenthèses)
Financement de la
thèse
Anna GRANDCHAMP 2015-2018
Philippe MONGET bourse MESR
Priscila BERTEVOLLO 2015-2018 Svetlana UZBEKOVA université
brésilienne
Mouhamad OSEIKRIA 2014-2017 Svetlana UZBEKOVA
(Sébastien ELIS)
bourse du gvt
syrien
10. Remarques éventuelles à signaler :
1
/
4
100%