pour accéder au document

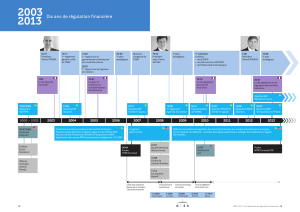
2017 UMR 7245 Molécules de Communication et Adaptation des Micro-organismes (MCAM)
Rôle de MIF (Macrophage Migration Inhibitory Factor) dans l'adaptation des filaires à leur hôte vertébré
Linda KOHL
Sujet de thèse:
Coralie MARTIN
Co-directeur(s) titulaire(s) HDR: Co-directeur(s) non-titulaire(s) HDR:
Equipe Biodiversité et Adaptation des Microorganismes Eucaryotes à leur Environnement (BAMEE)
Equipe:
Lefoulon E, [...], Martin C. Int J Parasitol. 2017. Sous presse.
Pionnier N, [...], Karadjian G, [...], Martin C. PLoS Negl Trop Dis. 2016. Apr 25;10(4):e0004605
Lefoulon E, [...], Martin C & Gavotte L. PeerJ. 2016 Mar 28;4:e1840.
Lefoulon E, [...], Martin C. PLoS Negl Trop Dis. 2015 Nov 20;9(11):e0004233.
Karadjian G, [...], Martin C. Parasite. 2014. 21:16.
Bouchery T, Lefoulon E, Karadjian G, [...], Martin C. Clin Microbiol Infect. 2013 Feb;19(2):131-40.
Gallet C, Demonchy R, [...], Kohl L. Mol Biochem Parasitol. 2013. 192(1-2), 49-54.
Bouchery T, [...], Martin C. Parasite. 2012 Nov;19(4):351-8.
Publications récentes des directeurs de thèse avec leurs anciens doctorants:
Les filaires sont des nématodes parasites tissulaires et vasculaires de nombreux vertébrés terrestres. Actuellement, plus de 150 millions de personnes
sont atteintes de filarioses (filariose lymphatique, onchocercose, loase) dans les régions tropicales et subtropicales. En 2015, le prix Nobel de médecine a
été décerné à W. Campbell et S. Omura pour leur découverte de l'ivermectine, le médicament antifilarien utilisé dans les programmes de traitement de
masse. Malgré ce traitement de masses, le contrôle et l'éradication de ces maladies n'ont pas été réalisés.
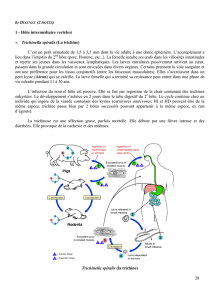
Le cycle biologique du parasite nécessite le passage par un arthropode vecteur hématophage. La transmission à l'hôte définitif s'effectue par pénétration
transcutanée du stade L3. Les L3 atteignent le stade adulte, mâle et femelle, en effectuant 2 mues. Les filaires s'accouplent pour donner naissance à de
nouvelles larves appelées microfilaires (ou L1). Les L1 sont récupérées par le vecteur lors de son repas sanguin. Deux mues se succèdent alors jusqu'au
stade L3. Certaines molécules sont exprimées à des stades précis du cycle biologique des filaires y assurant une fonction spécifique indispensable au
développement du vers mais aussi pouvant avoir un effet modulateur de la réponse immunitaire de l'hôte. Pour appréhender la fonction de telles
molécules il est nécessaire de pouvoir inhiber leur expression au niveau du nématode parasite, or les outils de génomiques fonctionnelles sont peu
développés chez ces organismes.
Dans ce projet nous nous intéressons aux cytokines et en particulier aux protéines MIF (Macrophage migration inhibitory factor). MIF est secrétée par de
nombreux types cellulaires mais aussi par des parasites tels que des vers nématodes (ankylostomes, filaires,..) et des protozoaires (Leishmania,
Plasmodium,..). Dans les filarioses, MIF modulerait la réponse de l'hôte pour favoriser une pathologie asymptomatique, ce qui représenterait un avantage
adaptatif pour les filaires.
Les mécanismes moléculaires sous-jacents dans l'interférence de MIF avec le système immunitaire de l'hôte restent à élucider.
Des résultats préliminaires du laboratoire d'accueil (obtenu dans le cadre d'un programme Chaires CAPES Sorbonne Universités 2016 avec l'Université
de Rio de Janeiro) ont montré que MIF jouerait un rôle important dans la survie des filaires: des souris auxquelles on a administré un anticorps bloquant
anti-MIF montrent une baisse de la charge parasitaire de 60%, et une diminution des macrophages dans la cavité broncho-alvéolaire.
Le projet développera des outils de génomique fonctionnelle afin de mieux comprendre la réponse immunitaire de l'hôte dans l'infection filarienne. Il
utilisera le modèle expérimental murin de filariose, L. sigmodontis, établi au laboratoire et qui permet de suivre le cycle parasitaire complet dans le vecteur
arthropode et le rongeur hôte.
Les objectifs du projet sont :
(1) Déterminer la localisation tissulaire de MIF chez la filaire dans les différents stades de développement du nématode, grâce aux anticorps spécifiques
anti-MIF de L. sigmodontis récemment produits au laboratoire d'accueil (stage de M2 d'E. Remion, direction L. Kohl, C. Martin).
(2) Etudier la fonction de MIF chez la filaire, en éteignant son expression par ARN interférence. Une étude comparative des méthodes des transfection
(trempage, éléctroporation, biolistique) sera réalisée pour les différents stades. En effet, les caractéristiques physiologiques de chacun des stades (taille,
viabilité en culture..) impliquent une adaptation des techniques. MIF ayant des propriétés chemoattractantes pour les neutrophiles, des essais de
migration in vitro seront réalisés. Une diminution de la migration des neutrophiles sera le signe d'une diminution de l'expression de MIF. Les niveaux
d'expression seront déterminés par RT-PCR et Western Blot, grâce à l'anticorps produit précédemment.
(3) Mesurer la réponse locale immunitaire /métabolique/ inflammatoire associée à l'inoculation des parasites modifiés. Les L3 modifiés seront injectés en
sous-cutanée aux rongeurs, et on évaluera le rendement et le développement parasitaire. Dans le cas de filaires adultes modifiées, une transplantation
des parasites sera réalisée dans la cavité péritonéale des rongeurs. On suivra ensuite l'état des utérus des filaires femelles et la microfilarémie sanguine.
Dans les 2 cas, on analysera la réponse immunitaire selon un protocole établi au laboratoire (phénotypage cellulaire et humoral).
Le projet combine les nouvelles informations du génome filarien avec les techniques de génomique fonctionnelle et aboutira à une meilleure
compréhension des mécanismes moléculaires qui sont en jeu dans l'infection filarienne chez l'hôte mammifère. L'approche fonctionnelle permettra à plus
long terme de valider des cibles thérapeutiques, en déterminant plus clairement leur mode d'action.
Descriptif du sujet de thèse et méthodes envisagées:
Le premier objectif (localisation de MIF en fonction du tissu et du stade) devrait permettre de rédiger une première publication à mi-parcours de la thèse.
Les études fonctionnelles de MIF et l'étude de la réponse locale immunitaire associée à l'inoculation des filaires
Stratégie de publication:
Directeur de thèse:

modifiées permettra au moins 1 publication supplémentaire.
La mise en place d'une technique de génie génétique par ARN interférence chez la filaire est un challenge, car difficile chez les nématodes parasites
d'animaux. Des études préliminaires réalisées dans le laboratoire d'accueil dans le cadre d'un récent projet Ile de France DIM Malinf (C. Martin UMR7245
& I. Vallée ANSES) montrent des résultats encourageants (introduction d'ARN double brin et premiers résultats d'extinction d'expression d'un gène).
En cas d'échec de l'extinction de l'expression de MIF chez la filaire, le sujet sera réorienté vers une analyse plus approfondie de la réponse immunitaire
des souris dépourvues de MIF (KO disponibles au laboratoire d'accueil) et en situation d'infection filarienne (aiguë ou chronique).
Réorientation possible du sujet si échecs:
Année 1 :
Formation expérimentation animale
Localisation de MIF chez la filaire (Immunofluorescence, imagerie confocale)
Mise au point des conditions d'extinction d'expression par ARNi (trempage, électroporation, biolistique)
Année 2 :
Déplétion de MIF chez la filaire (ARNi)
Validation du mutant MIF filaire (Western blot, qRT-PCR)
Test de migration cellulaire (in vitro)
Caractérisation des filaires MIF- chez la souris (in vivo)
Phénotypage de la réponse cellulaire de la souris (cytométrie en flux) et ELISA
Année 3 :
Caractérisation des filaires MIF- chez la souris (in vivo) - suite
Phénotypage cellulaire (Cytométrie en flux) et ELISA - suite
Au cours des 3 ans : Congrès et communications, et rapports et publications
Faisabilité sur 3 ans (échéancier):
Le candidat aura des connaissances en interactions hôte-parasite (nématodes) et des compétences techniques en biologie moléculaire et cellulaire
Profil du candidat recherché:
1
/
2
100%