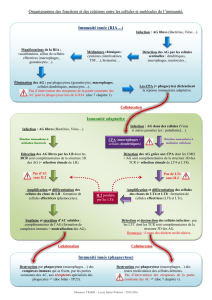
en details - EDBSL

FORMULAIRE PAR SUJET
I/ LE PROJET DE THESE
1) Titre du projet de thèse :
Réactivation des macrophages dormants au sein des tumeurs via l’inhibition de la proprotéine
convertase PC1/3 couplée à l’utilisation de ligands des récepteurs TLR.
2) Nom du Directeur de thèse : Pr. Michel Salzet
Date de l’obtention de l’habilitation à diriger des recherches : 23/05/1995
Nombre de doctorats en préparation sous la direction du directeur de thèse : 1
Adresse : Laboratoire PRISM, Inserm U1192, Bâtiment SN3, 1er étage, Université de Lille 1, 59650
Villeneuve d’Ascq
Téléphone : 03.20.43.41.94 Télécopie : 03 20 43 40 54 E-mail : michel.salzet@univ-lille1.fr
Nom d’un co-encadrant ou co-directeur de thèse (le cas échéant) :
Nom du laboratoire d’accueil du co-encadrant ou co-directeur de la thèse (si différent de celui du directeur de
thèse) :
E-mail du co-encadrant ou co-directeur de la thèse :
3) Ecole(s) doctorale(s) de rattachement :
SESAM - Sciences Economiques et Sociales, de l’Aménagement et du Management (ED73)
SHS - Sciences de l’Homme et de la Société (ED473)
SJPG - Sciences Juridiques, Politiques et de Gestion (ED74)
SMRE - Sciences de la Matière, du Rayonnement et de l’Environnement (ED104)
SPI - Sciences Pour l’Ingénieur (ED72)
BSL – Biologie Santé Lille (ED446)
4) Résumé du projet de thèse (en 20 lignes maximum) :
Le projet porte sur le développement d’une stratégie thérapeutique permettant de réactiver les macrophages
présents au sein des tumeurs. L’environnement immunosuppresseur créé par la tumeur va orienter les
macrophages vers un phénotype pro-tumoral. Ils vont alors participer à la croissance de la tumeur en agissant
directement sur les cellules cancéreuses mais aussi en supprimant les réponses cytotoxiques des lymphocytes
T. Ils représentent donc un élément clé de l’environnement tumoral. Le défi est de trouver un moyen pour
contrer cette immunosuppression et réactiver les macrophages. Notre stratégie consiste à utiliser un inhibiteur
des proprotéines convertases en combinaison avec un ligand des récepteurs TLRs pour réactiver les
macrophages tumoraux au sein des gliomes. Dans ce contexte, nous avons récemment démontré que
l’activation des macrophages pouvait être modulée via une enzyme appelée proprotéine convertase 1/3
(PC1/3). L’inhibition de cette enzyme déclenche une sécrétion abondante de facteurs immunitaires et oriente
les macrophages vers un phénotype M1 pro-inflammatoire. L’activation de ces macrophages est encore plus
importante lorsqu’on les stimule avec les ligands des récepteurs TLRs. Ces macrophages sécrètent également
des facteurs anti-tumoraux actifs contre les cellules de gliome et agissent également sur leur invasion. Notre
objectif est donc de développer une stratégie thérapeutique de réactivation des macrophages via la
combinaison d’un inhibiteur des proprotéines convertases et d’un ligand des récepteurs TLRs. Ces études
seront menées1) in vitro pour tester les différentes combinaisons, en utilisant un système de culture 3D
permettant de mimer la complexité tumorale, 2) sur un système ex vivo de culture d’explants tumoraux 3) in
fine sur des patients chien.

Projet de Recherche
Le sujet de recherche choisi et son contexte scientifique et économique
L’oncoimmunologie est un domaine en pleine expansion. En effet, les tumeurs présentent un
microenvironnement complexe composé de nombreux types cellulaires. Parmi eux, on peut retrouver les
cellules du système immunitaire (macrophages, lymphocytes T, B, NK). La plupart des stratégies développées
actuellement ciblent les lymphocytes T pour réactiver la réponse cytotoxique. La réponse des lymphocytes T
est inhibée dans les tumeurs via la reconnaissance du récepteur PD1 localisé en surface des lymphocytes T et
de son ligand PDL1 exprimé par les cellules cancéreuses et les macrophages pro-tumoraux. Or, la pleine
activation de ces lymphocytes nécessite de réactiver les macrophages pour qu’ils expriment un phénotype pro-
inflammatoire et anti-tumoral. Il est donc nécessaire d’agir en amont de cette voie PD1/PDL1. Les cellules
cancéreuses sécrètent divers facteurs anti-inflammatoires qui créent un environnement immunosuppresseur,
ainsi que des facteurs permettant le recrutement des macrophages. Les macrophages vont alors exprimer un
phénotype anti-inflammatoire et participer à la tumorigenèse. Il est indispensable que les macrophages
conservent un phénotype activé au sein des tumeurs pour qu’ils puissent ré-exercer leur fonction phagocytaire
et réactiver la réponse cytotoxique des cellules T. Notre stratégie consiste à utiliser un inhibiteur des
proprotéines convertases en combinaison avec un ligand des récepteurs TLRs au niveau des macrophages
pour les réactiver.
Nous avons récemment démontré que l’on pouvait moduler l’activation des macrophages et leur sécrétion
via une enzyme appelée PC1/3. L’inhibition de PC1/3 au niveau des macrophages module leur réponse
immunitaire vers une voie NF-κB MyD88 dépendante suite à l’activation des récepteurs TLR4 et TLR9. Au
contraire la voie anti-inflammatoire STAT3 est inhibée rendant les macrophages PC1/3 KD insensible à l’effet
de la cytokine inhibitrice IL10. Nous avons prouvé que PC1/3 était impliquée dans l’adressage des récepteurs
Toll-like. Son inhibition déclenche un adressage plus important du récepteur TLR9. Nous pensons que PC1/3,
qui est une enzyme protéolytique, pourrait être impliquée dans le clivage de protéines chaperonnes,
notamment la protéine UNC93B1. Ces résultats nous ont permis de mieux comprendre l’effet de PC1/3 sur
l’activation des macrophages. Dans une vision thérapeutique, nous avons également montré que ces
macrophages PC1/3 KD sécrétaient des facteurs anti-tumoraux qui ont notamment une activité envers les
cellules de gliome C6. Des expériences de culture en 3 dimensions ont révélé un effet sur l’invasion des cellules
cancéreuses. Ces résultats novateurs pourraient ouvrir une nouvelle voie thérapeutique en ciblant les
macrophages qui pourraient alors agir directement sur les cellules cancéreuses et sur l’activation des réponses
cytotoxiques.
Notre objectif est de développer une stratégie thérapeutique impliquant l’utilisation d’un inhibiteur des
proprotéines convertases en combinaison avec un ligand des récepteurs TLRs, qui puissent activer les
macrophages pour que ceux-ci induisent une réponse anti-tumorale. Les inhibiteurs commerciaux ciblent
plusieurs proprotéines convertases. En effet, l’inhibiteur commercialisé par la société Calbiochem cible la furine,
PC1/3, PACE4, PC4 et PC5/6. Nous avons démontré le rôle de PC1/3 dans la réponse immunitaire (Duhamel
et al
., 2016 ; 2016). Des études ont également prouvé que l’inhibition de la furine au niveau des lymphocytes
T activait leur réponse immunitaire (Pesu
et al.,
Nature, 2008). Une activation plus importante de la réponse
immunitaire pourrait donc être observée en inhibant plusieurs PCs. Les résultats préliminaires avec cet
inhibiteur montrent une activité sur la viabilité et l’invasion des cellules de gliome via les facteurs qui sont
sécrétés par les macrophages. Cet inhibiteur sera utilisé en combinaison avec un ligand des récepteurs TLRs.
Plusieurs pistes sont à l’étude, notamment le LPS et le 7-kétocholestérol qui se lient au récepteur TLR4. Nous
avons démontré le rôle du LPS sur l’activation des macrophages PC1/3 knockdown et son effet anti-tumoral.
Un autre ligand intéressant est le PolyIC qui se lie au récepteur TLR3. Le PolyIC a montré un effet positif sur
la réactivation des cellules microgliales isolées de gliome (Kees
et al.,
Neuro Oncol, 2012). Ces études seront
menées, dans un premier temps,
in vitro
avec un système de culture en 3 dimensions permettant de recréer
l’environnement tumoral. Cette technique est mise en place au laboratoire en collaboration avec le Dr Anne
Régnier-Vigouroux (Univ. Joseph Gutenberg zum Mainz, Allemagne) (Duhamel
et al.,
soumis). Dans un second
temps, la combinaison inhibiteur et ligand TLRs sera testé
ex vivo
sur des explants de tumeurs. En troisième
temps, une étude préclinique sera réalisée avec OCR sur le chien.
L’état du sujet dans le laboratoire et l’équipe d’accueil

Les stratégies développées en oncoimmunologie sont principalement basées sur l’activation de la réponse
cytotoxique des lymphocytes T et plus particulièrement l’inhibition de la voie PD1-PDL1. PDL1 est exprimée en
surface des cellules tumorales et macrophages et se lie à son récepteur PD1 exprimé par les lymphocytes T,
réprimant ainsi leur activité cytotoxique. Les macrophages sont également la source de facteurs anti-
inflammatoires qui vont participer à l’inhibition de cette activité cytotoxique. Ainsi, il est nécessaire d’agir sur
la réactivation des macrophages pour générer une réponse cytotoxique durable. Durant la tumorigenèse, les
macrophages sont recrutés par les cellules cancéreuses. L’environnement tumoral étant immunosuppresseur,
le phénotype des macrophages est orienté vers un phénotype anti-inflammatoire. On les appelle alors « tumor
associated macrophages » ou TAM. Les TAM vont sécréter des facteurs favorisant l’angiogenèse et la formation
de métastases, participant ainsi à la croissance tumorale. Ils vont aussi réguler négativement la réponse
immunitaire. Ils sont donc un point central de l’environnement tumoral. Le défi est donc de contrer cette
suppression immunitaire locale observée dans de nombreux cancers. Pour cela, nous nous focalisons sur les
macrophages. Nous avons démontré que l’inhibition de la proprotéine convertase 1/3 (PC1/3) dans les
macrophages provoquait leur activation vers un phénotype pro-inflammatoire. En effet, une sécrétion massive
de cytokines et chémokines pro-inflammatoires est observée avec ou sans stimulation du récepteur
TLR4 .Lorsque le récepteur TLR4 est activé, on observe une sécrétion abondante d’IL6, de TNF-α et de CXCL10
par les macrophages PC1/3 KD correspondant plutôt à une réponse pro-inflammatoire. De plus, nous avons
également observés que les facteurs sécrétés par les macrophages PC1/3 KD permettent le recrutement des
lymphocytes T CD4+ (Duhamel et al., 2015).
Pour s’approcher d’une stratégie thérapeutique, nous avons réalisé des stimulations des macrophages
avec le Taxol. L’avantage du Taxol est que c’est une drogue utilisé pour le traitement de différents cancers. Il
bloque la réplication des cellules cancéreuses en stabilisant les microtubules (Duhamel et al., Soumis). Son
2ème rôle est qu’il peut mimer l’action du LPS en se fixant sur le récepteur TLR4. Par conséquent, le Taxol
permettrait d’agir à la fois sur les cellules cancéreuses et sur l’activation des macrophages. La stimulation au
Taxol du récepteur TLR4 déclenche une sécrétion plus abondante des macrophages PC1/3 KD mais avec un
pattern également différent. De plus, nous avons mimé l’environnement immunosuppresseur de la tumeur en
ajoutant de l’IL10 dans le milieu des cellules. L’IL10 est largement sécrété par les cellules tumorales et est en
partie responsable de l’immunosuppression. Ici, on peut remarquer que l’ajout d’IL10 ne module pas ou très
peu la sécrétion des macrophages PC1/3 KD. Ils semblent donc être plus résistants à l’action d’une cytokine
inhibitrice. Nous avons également démontré que les sécrétomes avaient une activité anti-cancéreuse sur les
cellules de gliome de rat C6. Seuls les sécrétomes des macrophages PC1/3 KD stimulés au Taxol entraînent
une diminution significative de la viabilité des cellules C6 en comparaison de leur milieu de culture traditionnel.
Grâce à un système de culture en 3 dimensions, nous avons pu démontrer que les macrophages NR8383
préactivés au Taxol pouvaient réduire l’invasion des cellules cancéreuses. Les différences observées se trouvent
au niveau des protéines sécrétées. Les sécrétomes collectés à l’issue des 6 jours de co-culture entre les cellules
C6 et les macrophages montrent qu’en présence des macrophages PC1/3 KD, la majorité des protéines
sécrétées sont anti-tumorales tandis qu’avec les macrophages NT, elles sont pro-tumorales. Par contre, on
remarque qu’avec une autre lignée de gliome de rat F98, les macrophages PC1/3 KD préactivés au Taxol
permettent de réduire le potentiel métastatique des cellules cancéreuses (Figure 1) par rapport aux
macrophages NT préactivés au Taxol.
Figure 1 : Sphéroïdes de cellules de gliome de rat F98 en co-culture avec les macrophages NR8383 NT ou PC1/3 KD préactivés au
Taxol (30 µM) pendant 24h.

Des résultats préliminaires avec l’inhibiteur des PCs commercial (Calbiochem) ont démontré une sécrétion
active de facteurs pro-inflammatoires par les macrophages en présence de l’inhibiteur. De plus les facteurs
sécrétés par ces macrophages ont une activité antitumorale envers une lignée de cellules de gliome. Le point
important est que l’inhibiteur seul n’a pas d’effet sur la viabilité de ces cellules cancéreuses. Enfin, une
expérience de culture de sphéroïdes mixtes de cellules de gliome humaines NCH82 et de cellules microgliales
humaines a permis de déterminer l’invasion sous différentes conditions (Figure 2). On remarque que le PolyIC
seul permet de restreindre l’invasion des cellules cancéreuses dans le collagène par rapport au contrôle et la
combinaison inhibiteur des PCs et PolyIC diminue drastiquement l’invasion. Le PolyIC a déjà démontré des
effets intéressants sur la réactivation des cellules microgliales isolées de gliome humain (Kees
et al.,
2012).
Figure 2 : Sphéroïdes mixtes de cellules de gliome humain NCH82 et de cellules microgliales humaines en culture dans une matrice
de collagène pour mesurer l’invasion. Ces sphéroïdes ont été cultivés en présence de l’inhibiteur des PCs (50 µM) et/ou de PolyIC (25
µg/ml) pendant 6 jours.
Ces résultats sont donc très prometteurs et nécessitent des études supplémentaires
in vitro
, ex vivo et
in vivo.
Afin de valider notre stratégie. Avec la société Immune Insight nous avons réalisé des études préliminaires sur
des souris xénogreffées et humanisées avec des macrophages humains et les résultats montrent la migration
de ceux-ci après injection intrapéritonéale vers la tumeurr.
Principaux objectifs :
L’objectif 1 consiste à réaliser des tests
in vitro
pour trouver la bonne combinaison entre les ligands des
récepteurs TLRs et l’inhibiteur des proprotéines convertases (PCs). Différents ligands seront utilisés tels que le
7-ketocholesterol, le LPS pour le récepteur TLR4 et le PolyIC pour le récepteur TLR3. Ces expériences seront
menées sur la lignée de macrophages de rat NR8383 et la lignée de monocytes humains THP1 en combinaison
avec un inhibiteur commercial des proprotéines convertases (non sélectif pour PC1/3). Le but est de pouvoir
identifier le bon ligand permettant de générer une réponse anti-tumorale la plus efficace contre différentes
lignées de gliomes (C6 rat, NCH82 et U87 humaines). Il nous faudra donc caractériser les facteurs anti-
tumoraux sécrétés par les macrophages en présence de l’inhibiteur. Des tests de viabilité et d’invasion seront
également réalisés suite à des cultures en trois dimensions. Enfin, l’impact des facteurs sécrétés sur le
recrutement des lymphocytes T sera évalué. Le ligand le plus efficace sera ensuite utilisé pour répondre à
l’objectif 2.
Etapes clés : Il nous faudra caractériser les facteurs anti-tumoraux sécrétés par les macrophages en présence
de l’inhibiteur. Des tests de viabilité et d’invasion seront également réalisés suite à des cultures en trois
dimensions. Enfin, l’impact des facteurs sécrétés sur le recrutement des lymphocytes T sera évalué. Le ligand
le plus efficace sera ensuite utilisé pour répondre à l’objectif 2.
Résultats attendus : Pour cet objectif, nous attendons que la combinaison de l’inhibiteur et du ligand TLR
(LPS, 7-kétocholestérol ou PolyIC) permette de réactiver les macrophages vers un phénotype pro-
inflammatoire et déclenche leur sécrétion de facteurs immunitaires et anti-tumoraux. Ces macrophages
réactivés auront une action sur l’invasion des cellules de gliome dans un système en 3 dimensions et un effet
sur leur viabilité.
L’objectif 2 consiste à réaliser des tests
ex vivo
sur des organoïdes de gliome humain et murin. L’inhibiteur
des PCs et le ligand du TLR sélectionnés à partir de l’objectif 2 seront testés. La viabilité des explants sera
vérifiée par analyse cellulaire (Bleu alamar et kits LIVE/DEAD de Thermo). L’activité de la lactate
déshydrogénase permettra de mesurer la nécrose et l’apoptose sera analyser par marquage TUNEL. Puis, les
inhibiteurs et agonistes des TLRs préalablement sélectionnés seront ajoutés. L’effet de l’activation des
macrophages sur la tumeur sera mesuré par analyse de son volume, son poids et l’expression de marqueurs

spécifiques. Le traitement sera évalué en immunohistochimie avec des marqueurs de prolifération (KI67, MIB1)
ou de métastase (CDH1). Un marquage par du glucose 13C de l’explant tumoral en culture est envisagé. Ceci
permettra de discriminer les peptides et protéines sécrétés par la tumeur des peptides et protéines sécrétés
par les macrophages par des analyses protéomique. Ceci permettra de différencier les facteurs sécrétés en
fonction des traitements sur les macrophages, à plus large échelle que les marqueurs de prolifération et
métastases testés en ELISA (Interféron-gamma, IL-1β, TNF-α, IL-12 pour les phénotypes de type M1 et IL-
10, IL-1RA pour les macrophages de type M2).Les macrophages seront isolés des explants tumoraux par tri-
cellulaire en cytométrie en flux. Les états M1 ou M2 des macrophages seront déterminés par cytométrie en
flux selon les marqueurs de surface. Cette étude va ensuite se poursuivre par une étude
in vivo
sur un modèle
de souris xénogreffées avec la lignée de gliome U87 et humanisées avec des leucocytes humains. L’inhibiteur
des PCs et le ligand sélectionné à partir des objectifs 1 et 2 seront testés. L’effet de l’activation des
macrophages, via l’inhibiteur et le ligand sélectionné, sur la tumeur sera mesuré par analyse de son volume,
son poids et l’expression de marqueurs spécifiques. Cette partie sera réalisée en collaboration avec la société
Immune Insight.
Etapes clés : Les macrophages activés seront injectés dans les souris xenogreffées et leur infiltration au
niveau de la tumeur sera évaluée par fluorescence. Le traitement sera soit administré aux macrophages avant
leur injection, soit il sera administré à la souris après l’injection des macrophages. Les doses de traitement
devront être déterminées ainsi que le nombre de répétition du traitement seront évalués. Le volume, le poids
et l’expression de marqueurs spécifiques seront mesurés pour déterminer l’effet du traitement sur la tumeur.
Résultats attendus : L’inhibiteur et le ligand TLR sélectionné à l’issue du premier objectif devraient permettre
de réactiver les macrophages et de diminuer la taille des explants tumoraux.
Alternative : L’explant peut être dissocié et les cellules triées par cytométrie en flux. Des sphéroïdes seront
formés avec les cellules triées et nous pourrons tester notre stratégie thérapeutique (objectif 1).
L’objectif 3 consiste en la réalisation d’étude pré-clinique chez le patient chien. Cette partie sera réalisée en
collaboration avec la clinique vétérinaire Oncovet (OCR: Oncovet Clinical Research) qui possède l’équipement
et l’expertise nécessaires à ces études
in vivo
. Des chiens présentant des gliomes spontanés seront inclus dans
l’étude. Les inhibiteurs de PC couplés aux agonistes des TLRs seront injectés et la taille des tumeurs sera
mesurée par PET-scan et IRM. PRISM et OCR forment un laboratoire commun et une demande d’unité mixte
est en cours d’expertise à la région Nord Pas de Calais. L’impact du traitement sur les sécrétions de protéines
et sur le contenu protéique dans le CSF sera déterminé par spectrométrie de masse. De plus, du glucose 13C
sera injecté au niveau de la tumeur pour que les protéines nouvellement synthétisées soient marquées. Du
liquide cérébro-spinal sera prélevé et des exosomes seront purifiés. Les protéines provenant des exosomes
tumoraux dans le CSF seront identifiées par LC-MS/MS.
Résultats attendus : Nous pourrons avoir une première étude de faisabilité de notre traitement sur une
cohorte de patient chien développant des gliomes comme chez l’homme. Cette étude de phase 1 permettra
ensuite d’envisager une phase clinique.
Alternative : Si le traitement n’est pas efficace suite à une injection directe chez le chien, les macrophages
peuvent être isolés du sang et pré-activés avec l’inhibiteur et le ligand du TLR avant injection chez le chien.
Calendrier
Objectifs
Année 1
Année 2
Année 3
Mois
0-6
6-12
12-18
18-24
24-30
30-36
1
2
3
Les retombées scientifiques et économiques attendues
Notre stratégie thérapeutique est novatrice. En effet, contrairement à la plupart des études qui ciblent les
lymphocytes, nous avons choisi de réactiver les macrophages au sein des tumeurs via l’utilisation d’un
 6
6
1
/
6
100%