5 - AMPCfusion

Parcours 3 – Cours 5
Cours du 04/11 reporté au
24/11/15
Christian Poüs
RT : Helena Allera
Serena Anifrani
Cytosquelette et dynamique cellulaire :
physiologie et criblage thérapeutique
I. Les microtubules
A- La dynamique des microtubules
B- L’extrémité (+) du microtubule
C- Les régulateurs : les MAPs
D- Facteurs déclenchant les catastrophes
E- Régulateurs de la dynamique : les modifications post-
traductionnelles
F- L’extrémité (-) du microtubule
G- Test 1
II. Agents pharmacologiques
A- Colchicine
B- Taxol
C- Traitements
D- Conséquences de la réduction de la dynamique moléculaire
E- Moteurs moléculaires
F- Dynamique microtubulaire lors de la métaphase
G- Test 2
III. Cibles thérapeutiques
A- Fonctions ciblées
B- Néo-angiogenèse
IV. Les microfilaments

Lorsque l'on évoque le cytosquelette, on cite 3 composants :
Les microtubules
Les microfilaments d'actine
Les microfilaments intermédiaires (non évoqué dans ce cours)
Les composants du cytosquelette sont en interaction les uns avec les autres ou au moins avec un
des deux autres. En revanche les fonctions de ces composants sont étudiées de manière
individuelle pour simplifier les choses.
I. Les microtubules
Les microtubules prennent deux organisations différentes en fonction de la cellule :
en interphase :
o positionner les organites et les structures cytoplasmiques voire d'autres
éléments du cytosquelette;
o organisation de voies de signalisation (ex : la transmission de la membrane
plasmique au noyau est modulée par les éléments du cytosquelette);
o polarité et migration.
en mitose :
o formation d'un fuseau pour l'alignement et la ségrégation des chromosomes.
Les microtubules représentent une cible thérapeutique majeure notamment dans les
cancers : la cible privilégiée étant le constituant élémentaire du microtubule, le dimère de
tubuline (sous forme libre ou à l'état de microtubule il va être capable de lier des molécules à
action thérapeutique).
Il y a de nombreux sites de liaison possibles de molécule à action thérapeutique sur la tubuline
dont au moins 5 connus. Il y a donc une grande richesse de molécules pouvant s’y fixer.
A. Dynamique des microtubules
Le dimère de tubuline = une molécule α et β de tubuline qui sont associées et qui lient chacune
un nucléotide guanidique : le GTP pour l’α tubuline quelques soient les circonstances et soit du
GTP soit du GDP pour la β tubuline.
La β tubuline est un site échangeable : on peut passer d'un GDP à un GTP pour
permettre l’assemblage des tubulines. L’interaction entre les deux protéines va bloquer
l’accession du nucléotide guanidique à la poche de liaison dans la molécule d’α tubuline et va
donc empêcher cet échange, donc on aura toujours une molécule d’α tubuline liée à du GTP.
Le principe de l'assemblage de la tubuline pour former un polymère est : une molécule α
et β va être capable de s'incorporer dans un polymère : lorsque qu’un nouveau dimère lié au GTP
va venir se fixer sur le microtubule, l’ α tubuline du nouveau dimère va être en interaction avec
la β tubuline déjà présente sur le microtubule : cette interaction va stimuler l’activité GTPase
portée par la β tubuline : les molécules ayant été incorporées anciennement vont se
retrouver à l’état GDP donc toutes les dernières molécules incorporées vont conserver un
état GTP.
L’assemblage des dimères mène à la formation d’un protofilament. Ce protofilament
s’assemble à d’autres protofilaments pour former une structure cylindrique creuse constituée de
13 protofilaments, c’est le microtubule.
L’essentiel du microtubule est donc associé à du GDP sauf au niveau de la coiffe de GTP.
Attention : les microtubules sont polarisés : les 2 extrémités ne sont pas équivalentes :

extrémité ancienne (-) α tubuline
extrémité nouvelle (+) β tubuline
En réalité les microtubules sont dynamiques : l'incorporation de dimères se fait sous forme de
feuillet pour former le cylindre du microtubule les deux extrémités se rapprochent dans la
longueur en fermant ainsi le cylindre.
B. L'extrémité (+) du microtubule
-moteurs moléculaires
-kinésines vers +
-dynéines vers -
La dépolymérisation est rendue possible par la perte de la coiffe de tubuline GTP
(permet l’assemblage et la stabilité du protofilament).
La perte de cette coiffe permet aux protofilaments d'adopter une conformation
relâchée qui est en réalité portée à l’intérieur d’une molécule de GDP et permet au
protofilament de se courber vers l'extérieur du cylindre (à l’image d'une peau de banane que
l'on épluche) et les tubulines de GDP vont être libérées retournant ainsi à leur état libre dans
le cytosol où elles vont subir des échanges nucléotidiques pour retourner à l’état de tubuline
GTP.
Le principe d'équilibre entre forme libre et protofilament est une alternance d’une
phase de croissance et de dépolymérisation (la dépolymérisation est plus rapide que
l'assemblage).
La transition entre ces deux phases s’appelle la catastrophe.
Les microtubules en cours de dépolymérisation peuvent éviter une dépolymérisation totale et
être sauvée pour repartir vers une phase d’assemblage : c’est le sauvetage.
Ces propriétés permettent aux microtubules d'adopter un comportement dynamique :
c’est l’instabilité dynamique (alternance phase de croissance et de dépolymérisation).
Le comportement d'un microtubule donné est indépendant d'un microtubule voisin.

Etude d’un astère (structure de microtubules étoilés) au cours du temps :
Un astère : des microtubules reliés autour du centrosome.
Les microtubules sont reliés autour du centrosome. On voit qu'entre deux temps différents, des
microtubules se sont créées, allongés et se sont dépolymérisés. Cette étude démontre cette
instabilité dynamique au pôle (+).
Pour information : cette expérience est réalisée in vitro.
Si on trace une évolution de la taille d'un microtubule au cours du temps on y retrouve les
différentes phases.
Croissance Catastrophe Sauvetage Dépolymérisation
Phase de croissance lente
Catastrophe
Sauvetage
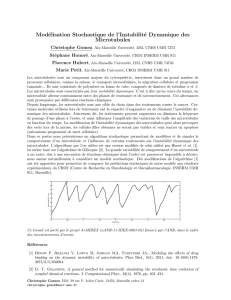
On peut mesurer les choses et les quantifier et à partir de ces documents on évalue des
fréquences de catastrophe, des vitesses de dépolymérisation…
Dans une cellule in vivo, l'instabilité dynamique existe aussi. On retrouve un comportement
dynamique avec alternance de phases de croissance, de dépolymérisation, de catastrophe et de
sauvetage.
À noter : tous les microtubules ne présentent pas de grandes amplitudes et de variations de
longueur importantes. Cela traduit d'une stabilité des microtubules qui a une importance
physiologique.
Récapitulatif :
L’instabilité dynamique a lieu à l’extrémité (+).
La coiffe de GTP permet la polymérisation.
S’il y a perte de cette coiffe, il y a dépolymérisation (catastrophe).
Cette dépolymérisation peut-être contrebalancée par un sauvetage permettant une
nouvelle phase de croissance.
En utilisant un anticorps recombinant sélectionné contre une tubuline GTP non
hydrolysable en GDP (c’est le GTPγ S), si on regarde le marquage, aux extrémités (+) on a un
microtubule avec un marquage rouge : présence de la coiffe avec GTP et dans la structure
interne il y a aussi un marquage rouge : conservation de la conformation tubuline GTP.
Cela permet d'obtenir une corrélation avec la localisation des sauvetages (ressemble
à une empreinte conformationnelle) : où il y a ce signal débute la phase de sauvetage.

Ceci illustre les propriétés dynamiques liées au bout (+) : traduction de la propriété de la
tubuline une fois assemblée dans la cellule.
Même si cette dynamique est possible in vitro, dans la cellule le microtubule va interagir avec
d'autres organites qui vont pouvoir amplifier ces propriétés dynamiques.
C. Les régulateurs : les MAPs (microtubule-associated proteins)
Les protéines MAPs vont interagir avec les microtubules en les tapissant et peuvent
stabiliser l’édifice moléculaire en s’associant à des tubulines voisines. Ces MAPs
correspondent aux MAPs structurales. Parmi celles-ci, certaines vont se lier spécifiquement au
voisinage de l’extrémité (+) ce sont les plus-end tracking proteins (+TIPs).
♡♡♡ EB1♡♡♡ : end-binding one : rôle de régulation de la dynamique des microtubules car
empêche les catastrophes et donc il y a polymérisation jusqu'à la périphérie de la cellule.
EB1 sert de plate-forme de recrutement de +TIPs associées ayant chacune un rôle sur la
dynamique microtubulaire (croissance, dépolymérisation, sauvetage, catastrophe).
EB1 (dimère) possède :
2 domaines CH : interaction directe avec la tubuline
Un domaine hydrophobe central qui permet de recruter des protéines possédant une
séquence tétrapeptidique : Sérine-X-Isoleucine-Proline (Ser-X-I-P)
Séquence C-terminal : composée de 2 acides glutamiques et d’une tyrosine ou une
phénylalanine (acide aminé aromatique). Cette séquence mime la séquence C-ter de l’α
tubuline et sert à recruter des protéines comme CLIP 170 qui vont interagir avec les
tubulines.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%