TP de thermodynamique n°3 : Mesure de γ - PCSI

1
TP de thermodynamique n°3 : Mesure de γ
Méthode de Clément et Desormes
I - Objectifs :
– Mesurer le rapport γ =
v
p
C
C
II - Etude théorique
• Montrer que dans un diagramme de Watt la pente de la représentation d’une transformation
adiabatique réversible est γ plus élevée que la pente de la représentation d'une
transformation isotherme réversible. On réalisera le raisonnement dans le cas d’un gaz
parfait mais le résultat est valable quelque soit le gaz.
On note :
• P
0
: la pression extérieure assimilée à la pression atmosphérique ;
• T
0
: température extérieure ;
• P
i
, T
i
, n
i
: la pression du gaz, la température et la quantité de gaz dans l’état i ;
• C
p
: capacité thermique molaire à pression constante ;
• C
v
: capacité thermique molaire à volume constant.
On assimile l’air à un gaz parfait diatomique.
• Choisir un système d’étude et décrire son évolution : on comparera en particulier les valeurs
des pressions, des températures et des quantités dans les trois états.
• Pourquoi peut-on considérer la transformation de l’état 1 à l’état 2 comme adiabatique et
réversible ?
• Qualifier la transformation de l’état 2 à l’état 3.
• Représenter les deux transformations précédentes sur un diagramme de Watt c'est-à-dire
dans un diagramme où l’on représente le volume en abscisse et la pression en ordonnée.
Comparer les températures des états 1 et 3. Sur quelle courbe se trouve les points qui
représentent les états 1 et 3 sur le diagramme de Watt.
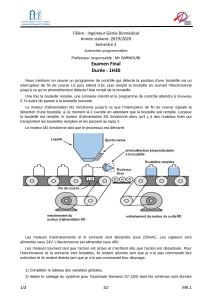
La bouteille ci-contre contenant de l'air possède 3 orifices. Le premier est
relié à un capteur de pression, le deuxième est relié à un robinet (B) qui
permet la communication entre la bouteille et l’extérieure et la dernière
(A) qui permet de créer une surpression dans la bouteille.
On créé une légère surpression dans la bouteille (état 1) puis on ouvre le
robinet (B). Le gaz qui se trouve dans le flacon se détend alors d'une
manière quasi-adiabatique réversible vers l'extérieur. Lorsque la pression
du flacon s'est équilibrée avec la pression extérieure (état 2), on referme le
robinet (B). Au bout d'un certain temps, le gaz emprisonné dans le flacon
revient à la température T
0
, on mesure alors la pression dans le flacon
(état 3).
P
∆
A B

2
• En considérant que les variations de volume et de pression sont faibles entre les différents
états, montrer que
31
21
PP PP
C
C
v
p
−
−
==
γ
III – Matériel disponible
- Bouteille étanche de volume V
0
constituant le flacon
- Tube en U pour mesurer les différences de pression entre l’intérieur et l’extérieur de la
bouteille.
- Tuyaux de raccordement
- Ballon de caoutchouc avec système de fermeture
IV - Travail expérimental à réaliser
- Avec le matériel dont vous disposez, réalisez cette expérience et calculez le coefficient γ
dans le cas de l'air. Commenter.
Travail complémentaire à réaliser si il reste du temps : Evaluer la constante de temps τ pour le
réchauffement du gaz en traçant P(t) après une détente ou une compression (on doit avoir une loi du
type α+βe
-t/τ
). Que cela signifie-t-il quant à l'expérience de mesure du coefficient γ?
V – Compte-rendu à rendre
Vous réaliserez un compte-rendu décrivant l’expérience réalisée (le protocole
expérimental sera détaillé précisément) et présentant les résultats expérimentaux obtenus.
Les étapes essentielles du raisonnement théorique seront présentées sans répondre
précisément aux questions posées à l’étude théorique qui sert de support.
1
/
2
100%