Diffusion Rutherford : Analyse et Expérience

Analyse documentaire : Diffusion Rutherford, Mouvement d’une particule dans un champ de
force newtonien électrostatique répulsif, Paramètre d’impact, Distance d’approche minimale.
L'expérience de Rutherford, menée en 1909 par Hans Geiger et Ernest Marsden sous la direction d'Ernest Rutherford, montra que la
partie chargée positivement de la matière (maintenant appelée noyau atomique) est concentrée en un espace de petit volume.
Le programme nous demande dans cette étude documentaire de relier l’échelle spatiale sondée à l’énergie mise
en jeu lors d’une collision en s’appuyant sur l’expérience de Rutherford.
Partie I) http://culturesciences.chimie.ens.fr/node/1230
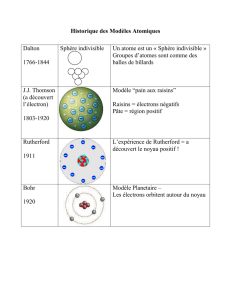
1. Présentation La notion d'atome est donnée pour la première fois par Démocrite entre -460 et -370 avant J.C. Il le définit
comme la plus petite partie insécable d'un corps simple. Il faudra cependant attendre le XIXème siècle, avec notamment J. Dalton et
A. Avodagro pour que l'atome passe d'un concept philosophique à un concept scientifique. Ce n'est qu'au début du XXème siècle
que l'on aura les moyens techniques pour sonder la matière à l'échelle subatomique.
2. Contexte scientifique La notion d'électron, ou "atome d'électricité", est posée par G. Stoney. La démonstration expérimentale
ainsi que la caractérisation de cette particule viendront avec J.J. Thomson. Celui-ci prouve que la matière est constituée de lourdes
parties positives et d'électrons, parties négatives plus légères, pour lesquelles il arrive à déterminer la charge et la masse. J.J.
Thomson entrevoit ainsi la notion d'atomes sécables. Pour respecter la vision classique de la matière continue, il propose le
modèle du "plum-pudding".
Figure 1. Schématisation du plum-pudding
Il imagine que les électrons, le "plum" se déplacent dans un milieu chargé positivement : le "pudding". La découverte, dans le
même temps par H. Becquerel de la radioactivité, est une étape décisive. En effet, E. Rutherford, ancien élève de J.J. Thomson, se
lance dans ce nouveau domaine et identifie les rayonnements α et β, en les distinguant selon leur pénétrabilité. Il montre que la
radioactivité α émet des particules : des noyaux d'Hélium.
3. L'expérience de Rutherford Pour étudier plus précisément le rayonnement α, E. Rutherford propose en 1909 de bombarder
une feuille d'or avec ces particules en plaçant un écran de détection tout autour de la feuille d'or.
Figure 2. Expérience de Rutherford
Le scintillement lumineux observé sur l'écran permet de visualiser la collision par les particules α. Au lieu de la répartition
statistique gaussienne attendue avec la théorie du "plum-pudding", l'expérience montre que la plupart des particules traversent la
feuille d'or sans déviation. E. Marsden et H. Geiger découvrent en affinant cette technique que des particules α (1 sur 8000) sont

déviées avec un angle supérieur à 90° [1]. Cette expérience met en évidence le caractère lacunaire de la matière et montre que les
charges positives de l'atome sont fortement localisées dans l'espace. E. Rutherford propose alors un modèle en accord avec cette
observation : le modèle planétaire.
Figure 3. Modèle planétaire
Il postule une représentation lacunaire de la matière où les électrons sont satellisés autour d'un noyau chargé positivement.
4. Critiques et perspectives Cependant ce modèle n'est pas en accord avec les lois de l'électromagnétisme. En effet, l'électron
sur son orbite est radialement accéléré et devrait donc rayonner selon la loi de Larmor. Ceci impliquerait une perte de l'énergie
totale de l'électron, qui s'écraserait alors sur le noyau. De plus, ce modèle n'explique absolument pas la série de Balmer du spectre
de l'hydrogène. N. Bohr propose alors, en s'inspirant des travaux de M. Planck, que le moment cinétique de l'électron est un
multiple entier de h. Ainsi l'électron ne peut rayonner car on lui impose une énergie sur une orbite donnée. Ce modèle, qui règle le
problème de l'instabilité du modèle planétaire, permet également de retrouver la série de Balmer. Par la suite, le modèle de Bohr
sera justifié par la mécanique quantique dans le cas particulier des hydrogénoïdes [2]. Il n'est pas valable dans les autres cas, car
N. Bohr postulait une orbite sphérique. Les problèmes posés par le modèle planétaire de E. Rutherford font état de l'impossibilité
de modéliser l'atome de manière satisfaisante grâce à la mécanique classique. Néanmoins, la mécanique quantique restant obscure
pour le plus grand nombre, le modèle planétaire demeure la représentation traditionnelle dans l'imaginaire populaire.
5. Bibliographie et ressources en ligne
[1] H. Geiger and E. Marsden, On a Diffuse Reflection of the α-Particles, Compte rendu de la Royal Society, 1909 A vol. 82, p.
495-500
[2] Un article culturesciences-chimie autour des atomes hydrogénoïdes et de l'approximation orbitalaire : Orbitales atomiques -
approximation orbitalaire
[3] Un article culturesciences-chimie : Le Modèle de Bohr
Questions sur la partie I :
1) Pourquoi le modèle planétaire de Rutherford-Bohr correspond-il mieux à la réalité expérimentale que
le modèle de Thomson ?
2) Il est dit dans le texte que le modèle de Bohr n’est pas cohérent avec la physique classique,
pourquoi ? Connaissez-vous un dispositif qui exploite le rayonnement d’une charge accélérée.

Partie II) Exercice corrigé : Etude d’un état de diffusion potentiel répulsif
On considère un noyau supposé ponctuel, de charge +Ze. Une particule de charge +2e, émise à l’infini se dirige vers le noyau.
De l’or Z=79. Sous l’effet de la force électrostatique répulsive, elle subit une déviation.
Comme les atomes d’or sont liés à la feuille d’or le site diffuseur peut être considéré comme infiniment massif et, on pourra
considérer que la particule α est diffusée par un centre diffuseur fixe.
La trajectoire est la branche d’hyperbole loin du foyer, le foyer étant occupé par la particule massive.
On appelle v la vitesse du mobile équivalent dans le référentiel du centre de masse bien avant le choc. On remarquera que dans ce
problème la constante de la loi des aires est négative. On sait que l’énergie dans le référentiel barycentrique s’exprime comme
E*= ½ m (dr/dt)² +U(r)+ mC²/(2r²) où r est la position du mobile équivalent dans le référentiel du centre de masse et où U(r) est
l’énergie potentielle d’interaction des deux particules dont la force d’interaction
F = k.ur/r² dérive avec k = [ 1 / ( 4 0 ) ] * 2 * Z * e²>0 et F = - grad U
1) Montrer que v et v’ vitesse du mobile équivalent bien après la diffusion ont même module
2) De la symétrie de la trajectoire déduire que p est dans la direction de GA avec A point d’approche minimal du mobile fictif
3) p = lim t - et t’ + tt’ F dt. Grâce à la loi des aires effectuer dans cette intégrale le changement de variable t en et
calculer p en fonction de k C et D. où C est la constante de la loi des aires.
4) Exprimer C en fonction de b et de v puis en déduire D en fonction de k,b, m et v
5) Calculer la distance minimale d’approche ou tout du moins poser l’équation qui permet de la déterminer.
6) Calculer l’excentricité de l’hyperbole en fonction des paramètres physiques du problème
7) Quelle équation en polaire décrit une branche d’hyperbole loin du foyer (potentiel répulsif)
1) '
2)
1 1 1
3) . . cos cos ²
² ² ² ²
rr
conservation de l energie
le graphe ci contre montre la construction de p
d p k GA k GA k d d d
p dt u dt p u dt dt k dt car C r
dt r r r C dt dt r C d
GA GA
2
. cos sin sin
in( ) cos( )
22 2 2
cos sin tan 2 tan tan( ) tan
2 2 2 2 2
( ) sin( )
2 2 2
²
4) tan est voisin de la m
2 2 2
t
GA k k k
pd
C C C
GA
DD
s
p C p C p C
k D D
p or D co
DD
C k k k
cos
mv bv mv b
D
C bv co m
kk
2 2 2 2
2 2 2
²
6) ( ² 1)
2
asse de la particule
1 1 1 1 1 ² 1
5) ² ² à la distance d'approche minimale on a
2 2 2 ² 2 2 ² 2
dr d k dr C k C k
m r mv m r mv m mv
dt dt r
kL
E e avec
dt r
p
p km
r r r
22
22
²
² ² ² ² 1
( ² 1) ( ² 1) si on identifie à on peut trouver e
2
² 2 ²
2
p1
7) branche d'hyperbole répulsive r = comme e>1 arccos( )
ecos( )-1
mb v
m C mC k k
E e e mv
km k k mb v mb v
k
e
Questions sur la partie II :
1) En exploitant les résultats de cette étude montrer qu’une rétrodiffusion est possible.
(Réponse si v= 0 ou b=0, cotan D/2=0 soit cos D/2 =0 soit D=π)
2) Montrer que la distance minimale d’approche diminue avec l’énergie de la particule incidente ;
Pour quelle valeur de b s’approche-t-on au plus près ?
3) Ce modèle permet-il d’accéder à la taille du noyau ?
Rutherford a estimé rnoyau < 3 10-14m, pourriez-vous en déduire que la vitesse des particules α incidentes dans cette
expérience est de 2 107m /s
b
D
G, Ze
b
M
A
v
v’
p
pF
pI
G

Partie III) Notion de ‘’section efficace de diffusion’’ dans un modèle 2D
(non distribuée)
On irradie une zone du plan avec un faisceau parallèle de particules correspondant à un flux 0 (particules
par mètre et par seconde), ces particules sont diffusées par des centres diffuseurs distants de a les uns des
autres et positionnés sur une ligne de longueur L.
Soit dN le nombre de particules détectées dans les directions entre les directions θ et θ + dθ et par unité de
temps, on doit avoir dN ~ 0 dθ (L/a)
Appelons l(θ) la constante de proportionnalité dN = l(θ) 0 dθ (L/a)
Elle possède la dimension d’une longueur par radian, on l’appellera longueur efficace de diffusion et elle est
l’analogue quand on passe à trois dimensions à ce qui s’appelle une section efficace de diffusion.
Remarque : Il existe un concept de longueur de diffusion en 3D que l’on ne confondra pas avec notre outil 2D de longueur efficace de diffusion
dN = l(θ) . 0 . dθ . (L/a) vérification des dimensions s-1 = m rad-1. m-1s-1 . rad
On suppose la présence de centres diffuseurs circulaires de rayon R périodiquement répartis et on irradie la
zone de largeur L calculer l(θ) et
()ld
que l’on appellera longueur totale de diffusion
Le problème de la diffusion Rutherford est traité par exemple dans le livre de Perez aux éditions Dunod
Mécanique : fondements et applications 7eme édition. La notion de section efficace en particulier y est développée.
1
/
4
100%