Le développement neuronal - Service Central d`Authentification

Université de Nantes
Faculté de Médecine
Le développement neuronal :
rôle de la protéine adaptatrice CD3zeta
et mécanismes régulant la fonction du
récepteur de chimiokine CXCR4
THESE DE DOCTORAT
Ecole Doctorale Biologie Santé
Discipline : Sciences de la vie et de la santé
Spécialité :Neurobiologie
Présentée et soutenue publiquement par
Stéphane BAUDOUIN
Le 30 janvier 2008, devant le jury ci-dessous:
Président : Pascal DERKINDEREN, Professeur des Universités, Nantes
Rapporteurs: Ann LOHOF, Professeur des Universités, Paris
William ROSTENE, Directeur de Recherche, Paris
Examinateur: Alain BESSIS, Chargé de Recherche, Paris
Directeur de thèse: Hélène BOUDIN, Chargée de Recherche, Nantes

1
SOMMAIRE
Abréviations utilisées................................................................................. 3
Liste des figures ....................................................................................... 5
Liste des tableaux..................................................................................... 6
Avant propos............................................................................................ 7
INTRODUCTION.......................................................................................10
1 Le développement neuronal....................................................................11
1-1 La mise en place des structures anatomiques du cerveau......................11
1-2 La migration neuronale ....................................................................13
1-3 Spécification de la polarité neuronale.................................................15
1-4 Des sous structures essentielles au développement : cône de croissance
et filopode ...........................................................................................18
1-4-1 Définitions.............................................................................18
1-4-2 Dynamique des composants du cytosquelette et des microtubules
dans la croissance...........................................................................20
1-5 Facteurs régulant la formation des prolongements...............................24
1-5-1 Les facteurs intrinsèques.........................................................24
1-5-2 Les facteurs extrinsèques ........................................................30
1-6 L’établissement des contacts synaptiques ...........................................35
1-7 Une classe de molécules émergente dans le développement du système
nerveux central : les molécules du système immunitaire ............................37
1-7-1 Le complexe majeur d’histocompatibilité de classe I (CMH I) et les
molécules associées ........................................................................38
1-7-2. Les molécules à domaines ITAM et ITIM ...................................42
1-7-3. Les molécules du complément.................................................43
1-7-4. Les récepteurs toll-like...........................................................44
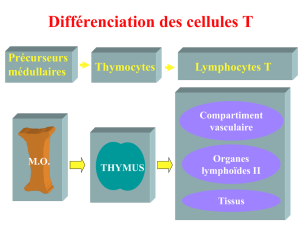
2 CD3! : molécule adaptatrice dans les systèmes immunitaire et nerveux........46
2-1 Structure de CD3!...........................................................................46
2-2 Les récepteurs couplés à CD3! et les fonctions associées......................49
2-3 Signalisation intracellulaire déclenchée par l’activation de CD3!............55
2-4 CD3! dans le système nerveux central ...............................................58
3 La chimiokine SDF-1 et son récepteur CXCR4............................................60
3-1 Les chimiokines et leurs récepteurs....................................................60
3-2 La chimiokine SDF-1 et son récepteur CXCR4 dans le SNC ....................61
3-2-1 La chimiokine SDF-1...............................................................61
3-2-2 Le récepteur CXCR4................................................................62
3-2-3 Rôles physiologiques de SDF-1 et CXCR4 dans le cerveau............63
3-3 La régulation de l’expression par les voies d’endocytose. ......................66
Objectifs de l’étude ..................................................................................69

2
RESULTATS.............................................................................................71
Article n°1: La protéine adaptatrice de signalisation CD3! est un régulateur
négatif du développement des dendrites dans les neurones immatures ..72
Article n°2: Redistribution sélective au niveau des dendrites du récepteur de
chimiokine CXCR4 suite à une stimulation agoniste..............................87
DISCUSSION et PERSPECTIVES ................................................................ 98
Conclusion ............................................................................................113
BIBLIOGRAPHIE.....................................................................................114

3
Abréviations utilisées
+TIP : plus end tracking protein
Actine-F/G : actine filamenteuse/globulaire
BAT-3 : antigen-b-associated 3
BNDF : brain-derived neurotrophic factor
CBP: CREB binding protein
CMH I : complexe majeur d’histocompatibilité de type I
CREB : cAMP response element binding
CREST : calcium-response transactivator
Dscam : Down syndrome-related cell adhesion molecule
ECM : éléments de la matrice extracellulaire
ERK : extracellular signal-regulated kinase-1
Fc/Ig : fragment constant (Fc) des immunoglobulines (Ig)
GAP: protéines activatrices des GTPases
GEF : facteurs d’échange de la guanine
GFP: green fluorescent protein
GITR : glucocorticoid-induced tumor necrosis factor receptor-related
GRK : G-proteins kinases coupled receptor
ITAM : immunoreceptor tyrosine-based activation motif
LAT : linker for activation of T cells
LRR : leucine-rich repeat
LT : lymphocyte T
MAC : molécules d’adhésion cellulaire
MAP/MAP2 : microtubules associated molecules
MAPK : mitogen-activated protein kinases
NFAT : nuclear factor of activated T-Cell
NF-kB: nuclear factor kappa-light-chain-enhancer of activated B cells
NgCAM : molécule d'adhésion cellulaire neurone-glie
NGF : nerve growth factor
NGL : noyau géniculé latéral
NK : natural killer
NT-3/NT-4 : neurotrphine-3/-4
P75NTR : récepteur aux neurotrophines p75

4
PDZ : PSD-95 discs large zona occludens-1
PI3K : phosphoinositide-3-kinase
PLCg : phospholipase C g
PKC/aPKC: protéine kinase C, PKC atypique
PMA : phorbol 12-myristate 13-acetate
PP2 : 4-amino-5-(4-chlorophenyl)-7-(t-butyl)pyrazolo[3,4-d]pyrimidine
PSD : densité post-synaptique
PSD-95 : protéine de la densité post-synaptique-95
RCPG : récepteur couplé aux protéines G
SDF-1 : Stromal Derived Factor-1
Sema3A : sémaphorine 3A
SH2/SH3 : src homology domain 2/3
SI : système immunitaire
SNC : système nerveux central
Syk : spleen tyrosine kinase
TCR : récepteur des cellules T
Trk : récepteur tyrosine kinase
TTX : tétrodotoxine
VAMP2 : protéine membranaire associée aux vésicules 2
ZAP70 : !-associated protein
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
1
/
133
100%